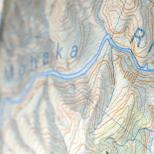
分子結晶格子の例。 金属の結晶構造
自然界には、性質が著しく異なる2種類の固体があります。 これらはアモルファス体と結晶体です。 また、アモルファス体には正確な融点がなく、加熱中に徐々に柔らかくなり、その後流動状態になります。 そのような物質の例は、樹脂または通常の粘土です。 しかし、結晶性物質の場合は状況がまったく異なります。 それらは特定の温度まで固体状態を保ち、それに到達した後でのみ、これらの物質は溶けます。
それはすべて、そのような物質の構造に関するものです。 結晶体では、それらを構成する粒子は特定の点に位置しています。 そして、それらを直線で結ぶと、結晶格子と呼ばれる一種の架空のフレームが得られます。 また、結晶格子の種類は非常に異なる場合があります。 そして、それらが「構築」される粒子のタイプに応じて、格子は4つのタイプに分けられます。 これらは、イオン、原子、分子、
そして、ノードにはそれぞれイオンがあり、それらの間にはイオン結合があります。 単純 (Cl-、Na+) と複雑 (OH-、SO2-) の両方が可能です。 そして、これらのタイプの結晶格子には、金属の水酸化物や酸化物、塩、その他の類似物質が含まれている場合があります。 たとえば、通常の塩化ナトリウムを考えてみましょう。 立方晶格子を形成する負の塩素イオンと正のナトリウムイオンが交互に現れます。 このような格子内のイオン結合は非常に安定しており、この原理に従って「構築された」物質は十分に高い強度と硬度を持っています。
原子と呼ばれる結晶格子の種類もあります。 ここでは、原子は節にあり、その間に強い共有結合があります。 原子格子を持つ物質は多くありません。 これらには、ダイヤモンド、結晶ゲルマニウム、シリコン、ホウ素が含まれます。 それぞれ原子結晶格子を含む、または持つ、より複雑な物質がいくつかあります。 これらは水晶とシリカです。 そしてほとんどの場合、そのような物質は非常に強く、硬く、耐火性があります。 また、実質的に不溶性です。
そして、結晶格子の分子型にはさまざまな物質があります。 これらには、凍った水、つまり通常の氷、「ドライアイス」 - 固化した一酸化炭素、および固体の硫化水素と塩化水素が含まれます。 分子格子にも多くの固体があります 有機化合物. これらには、砂糖、ブドウ糖、ナフタレン、およびその他の類似物質が含まれます。 そして、そのような格子のノードにある分子は、極性および非極性の化学結合によって相互接続されています。 そして、分子内の原子間に強い共有結合があるという事実にもかかわらず、これらの分子自体は非常に弱い分子間結合のために格子内に保持されます. したがって、そのような物質は非常に揮発性が高く、簡単に溶け、硬度が高くありません。
まあ、金属は最も多くを持っています 他の種類結晶格子。 また、ノードには原子とイオンの両方を含めることができます。 同時に、原子は容易にイオンになり、電子を「 一般的な使用"。 同じように、イオンは自由電子を「捕獲」して原子になることができます。 そして、そのような格子は、延性、可鍛性、熱伝導率、電気伝導率などの金属の特性を決定します。
また、金属などの結晶格子の種類は、格子の素格子の形状によって大きく7つの系統に分けられます。 最も単純なのは立方体セルです。 結晶格子全体の形状を決定する菱形、正方晶、六角形、菱面体晶、単斜晶、および三斜晶の単位セルもあります。 しかし、ほとんどの場合、結晶格子は上記のものよりも複雑です。 これは、 素粒子格子のノードだけでなく、その中心または面にも配置できます。 金属の中で最も一般的なのは、面心立方、体心立方、六方最密の 3 つの複雑な結晶格子です。 もっと 体格的特徴金属は、結晶格子の形状だけでなく、原子間距離やその他のパラメーターにも依存します。
物質の構造。
化学的相互作用に入らない 個々の原子または分子ですが、物質です。
私たちの仕事は、物質の構造に精通することです。
低温では、物質は安定した固体状態にあります。
☼ 自然界で最も硬い物質はダイヤモンドです。 彼はすべての宝石の王と見なされており、 貴重な石. その名前そのものがギリシャ語で「不滅」を意味します。 ダイヤモンドは古くから奇跡の石とされてきました。 ダイヤモンドを身に着けている人は胃の病気を知らず、毒は彼に影響を与えず、老後まで記憶と陽気な気分を保ち、王室の好意を享受していると信じられていました。
☼ 宝石加工(カット、研磨)を施したダイヤモンドをダイヤモンドと呼びます。
溶融中、熱振動の結果として、粒子の順序が乱れ、粒子が可動になりますが、化学結合の性質は損なわれません。 したがって、固体状態と液体状態の間に基本的な違いはありません。
流動性は液体に現れます(つまり、容器の形を取る能力)。
液晶。
液晶は 19 世紀の終わりに発見されましたが、ここ 20 ~ 25 年間研究されてきました。 現代技術の多くのディスプレイデバイス。 デジタル腕時計液晶で動くミニコン。
一般に、「液晶」という言葉は「ホットアイス」と同じくらい珍しいように聞こえます。 ただし、実際には氷も熱くなることがあります。 10,000気圧以上の圧力で。 水の氷は 2000 ℃ を超える温度で溶けます。「液晶」の珍しい組み合わせは、液体状態が構造の可動性を示し、結晶が厳密な秩序を前提としていることです。
物質が細長い形状またはラメラ形状の非対称構造を持つ多原子分子で構成されている場合、それらが融解すると、これらの分子は互いに特定の方向に配向します (それらの長軸は平行です)。 この場合、分子はそれ自体に平行に自由に移動できます。 システムは、液体の流動特性を取得します。 同時に、このシステムは、結晶の特性を決定する規則的な構造を保持します。
このような構造の高い可動性により、非常に弱い影響(熱、電気など)によって制御することが可能になります。 現代の技術で使用されている非常に少ないエネルギーで、光学特性を含む物質の特性を意図的に変更します。
結晶格子の種類。
あらゆる化学物質が形成される 多数相互接続された同一の粒子。
低温で熱運動が妨げられると、粒子は空間内で厳密に配向し、結晶格子を形成します。
結晶格子自体では、ノードとノード間スペースが区別されます。
条件 (p、t、...) に応じて、同じ物質が異なる結晶形で存在します (つまり、異なる結晶格子を持っています) - 特性が異なる同素体変態です。
たとえば、炭素の 4 つの修飾が知られています - グラファイト、ダイヤモンド、カービン、ロンズデーライトです。
☼ 第四の結晶性炭素「ロンズデーライト」はあまり知られていません。 隕石から人工的に発見され、その構造は現在も研究されています。
☼すす、コークス、木炭は、炭素の非晶質ポリマーとして分類されました。 しかし、これらも結晶性物質であることがわかってきました。
☼ちなみに、すすの中に「ミラーカーボン」と呼ばれる、ピカピカの黒い粒子が発見されました。 ミラーカーボンは化学的に不活性で、耐熱性があり、ガスや液体を通さず、滑らかな表面と生体組織との完全な適合性を備えています。
☼ グラファイトの名前は、イタリア語の「graffito」に由来します。 グラファイトは、わずかに金属光沢のある濃い灰色の結晶で、層状の格子があります。 互いに比較的弱く結合しているグラファイト結晶内の原子の別々の層は、互いに容易に分離されます。
結晶格子の種類



結晶格子の異なる物質の性質(表)
冷却時に結晶成長速度が遅いと、ガラス状態(非晶質)が形成されます。
周期系における元素の位置とその単体の結晶格子との関係。
周期表における元素の位置と、それに対応する元素の結晶格子との間には密接な関係があります。

残りの元素の単体は、金属結晶格子を持っています。
固定
講義資料を研究し、ノートに次の質問に答えてください。
- 結晶格子とは何ですか?
- 結晶格子にはどのような種類がありますか?
- 計画に従って各タイプの結晶格子を説明します。
結晶格子の節には何があり、構造単位 → 節の粒子間の化学結合の種類 → 結晶の粒子間の相互作用の力 → 結晶格子による物理的性質 → 凝集状態通常状態の物質 → 例
このトピックに関するタスクを完了します。
- 日常生活で広く使われている次の物質はどのような結晶格子を持っていますか: 水、酢酸 (CH3 COOH)、砂糖 (C12 H22 O11 )、 カリ肥料(KCl)、川砂 (SiO2) - 融点 1710 ℃、アンモニア (NH3)、食卓塩? 一般化された結論を下してください: 結晶格子のタイプを決定できる物質の特性は何ですか?
与えられた物質の式に従って:SiC、CS2、NaBr、C2 H2 - 各化合物の結晶格子のタイプ(イオン、分子)を決定し、これに基づいて、4つの物質のそれぞれの物理的性質を説明します。
トレーナーナンバー1。 「クリスタルグリッド」
トレーナーナンバー2。 「テストタスク」
テスト (セルフコントロール):
1) 原則として、分子結晶格子を有する物質:
a)。 耐火性で水によく溶ける
b)。 可溶で揮発性
V)。 固体で導電性
G)。 熱伝導性とプラスチック
2) 物質の構造単位に関しては、「分子」の概念は適用されません。
b)。 空気
V)。 ダイヤモンド
3) 原子結晶格子は、次の特徴があります。
a)。 アルミニウムとグラファイト
b)。 硫黄とヨウ素
V)。 酸化ケイ素と塩化ナトリウム
G)。 ダイヤモンドとホウ素
4) 物質が水に非常に溶けやすく、融点が高く、導電性がある場合、その結晶格子は次のようになります。
A)。 分子の
b)。 原子力
V)。 イオン性
G)。 メタリック
通常の状態では気体ですが、-194°Cの温度で液体に変わります 青色、私は-218.8ºCの温度で青い結晶からなる雪のような塊に固まります。
このセクションでは、化学結合の特徴が固体の特性にどのように影響するかを検討します。 固体状態の物質が存在するための温度間隔は、その沸点と融点によって決まります。 固体は、結晶性と非晶性に分けられます。
非晶質の物質には明確な融点がありません。加熱すると、徐々に柔らかくなり、液体になります。 アモルファス状態には、例えば粘土や様々な樹脂があります。
結晶性物質は、それらを構成する粒子 (原子、分子、イオン) が正しく配置されているという特徴があります。 - 空間内の厳密に定義されたポイント。 これらの点が直線で結ばれると、結晶格子と呼ばれる空間フレームが形成されます。 結晶の粒子が配置されているポイントは、格子を配置すると呼ばれます。
仮想格子のノードには、イオン、原子、および分子を含めることができます。 これらの粒子は振動します。 温度が上昇すると、これらの振動の範囲が広がり、通常、体の熱膨張につながります。
結晶格子のノードに位置する粒子のタイプとそれらの間の結合の性質に応じて、イオン、原子、分子、および金属の 4 つのタイプの結晶格子が区別されます (表 6)。
表6に示されていない残りの元素の単体は、金属格子を有する。
イオン結晶格子が呼び出され、そのノードにはイオンがあります。 それらは、単純なイオンNa +、Cl-、および複雑なSO 2-4、OH-の両方に関連付けることができるイオン結合を持つ物質によって形成されます。 したがって、イオン結晶格子には、塩、一部の金属酸化物および水酸化物、つまりイオン化学結合が存在する物質があります。 たとえば、塩化ナトリウムの結晶は正の Na+ イオンと負の Cl- イオンが交互に並んで立方体の格子を形成します。 このような結晶内のイオン間の結合は非常に安定しています。 したがって、イオン格子構造を持つ物質は比較的高い硬度と強度を持ち、耐火性と不揮発性です。
原子結晶は結晶格子に注がれ、そのノードには個々の原子があります。 このような格子では、原子は非常に強力な共有結合によって相互接続されています。 このタイプの結晶格子を持つ物質の例は、炭素の同素変態の 1 つであるダイヤモンドです。
原子結晶格子を持つ物質の数はそれほど多くありません。 これらには、結晶ホウ素、シリコン、ゲルマニウム、および複雑な物質、たとえば酸化ケイ素(IV)-SlO2:シリカ、石英、砂、水晶などがあります。
原子結晶格子を持つほとんどの物質は非常に高い融点を持ち (たとえば、ダイヤモンドでは 3500 ºC 以上)、それらは強くて硬く、実質的に不溶性です。

分子格子は結晶格子と呼ばれ、そのノードに分子が配置されています。 これらの分子の化学結合には、極性と非極性の両方があります。 分子内の原子が非常に強力な共有結合によって接続されているという事実にもかかわらず、分子自体の間で作用します 弱い力分子の引力。 したがって、分子結晶格子を持つ物質は硬度が低く、融点が低く、揮発性があります。

分子結晶格子を持つ物質の例は、固体水 - 氷、固体一酸化炭素 (IV) - 「ドライアイス」、固体塩化水素および硫化水素、1- (希ガス)、2-、3- ( O3)、4-(P4)。 8原子分子。 ほとんどの固体有機化合物は、分子結晶格子 (ナフタレン、グルコース、糖) を持っています。
金属結合を持つ物質は、金属結晶格子を持っています。 このような格子のノードには、原子とイオンがあります (金属原子が容易に変化し、共通の使用のために外側の電子を与える原子またはイオンのいずれか)。 そのような 内部構造金属は、延性、延性、電気および熱伝導性、特徴的な金属光沢などの特徴的な物理的特性を決定します。
分子構造を持つ物質には、フランスの化学者J.L.プルースト(1799-1803)が発見した組成不変の法則が有効です。 現在、この法則は次のように定式化されています。 化学物質それらの調製方法に関係なく、それらは一定の組成と特性を持っています。 プルーストの法則は、化学の基本法則の 1 つです。 ただし、イオンなどの非分子構造を持つ物質の場合、この法則は常に有効とは限りません。
1. 物質の固体、液体、気体の状態。
2. 固体: 非晶質および結晶質。
3. 結晶格子: 原子、イオン、金属、分子。
4.組成の恒常性の法則。
羊毛製品を蛾から保護するためのナフタレンの使用の根底にある特性は何ですか?
個々の人の性格特性の説明に適用できるアモルファス体の性質は何ですか?
1825年にデンマークの科学者K.X.エルステッドによって発見されたアルミニウムは、なぜ長い間貴金属として扱われてきたのでしょうか?
A. Belyaevの「空気の売り手」の作品を思い出し、本に記載されている説明を使用して固体酸素の特性を特徴付けます。
金属の融点が非常に広い範囲で変化するのはなぜですか? この質問への回答を準備するには、追加の文献を使用してください。
シリコン製の製品は衝撃で粉々に砕けるのに、鉛製の製品は平らになるのはなぜですか? 次のうち、化学結合の破壊が起こるのはどれで、起こらないのはどれ? なぜ?
物質の分子および非分子構造。 物質の構造

化学的相互作用に入るのは個々の原子や分子ではなく、物質です。 物質は結合の種類によって区別されます 分子のと 非分子構造. 分子で構成された物質は呼ばれます 分子物質. そのような物質の分子間の結合は非常に弱く、分子内の原子間の結合よりもはるかに弱く、すでに比較的低い温度で壊れます-物質は液体になり、次に気体になります(ヨウ素昇華)。 分子からなる物質の融点と沸点は、 分子量. に 分子物質原子構造(C、Si、Li、Na、K、Cu、Fe、W)を持つ物質が含まれ、その中には金属と非金属があります。 物質へ 非分子構造イオン化合物が含まれています。 金属と非金属のほとんどの化合物はこの構造を持っています:すべての塩(NaCl、K 2 SO 4)、一部の水素化物(LiH)と酸化物(CaO、MgO、FeO)、塩基(NaOH、KOH)。 イオン性(非分子)物質融点と沸点が高い。

固体: 非晶質および結晶質
固体は次のように分類されます。 結晶性および非晶質.
非晶質物質明確な融点はありません-加熱すると、徐々に柔らかくなり、流動的になります。 非晶質状態には、例えば粘土や様々な樹脂があります。
結晶性物質空間内の厳密に定義された点で、原子、分子、イオンなどの粒子が正しく配置されていることが特徴です。 これらの点が直線で結ばれると、結晶格子と呼ばれる空間フレームが形成されます。 結晶粒子が位置する点は、格子節と呼ばれます。 結晶格子のノードに位置する粒子のタイプと、それらの間の接続の性質に応じて、イオン、原子、分子、および金属の 4 つのタイプの結晶格子が区別されます。
結晶格子はイオン性と呼ばれます、そのサイトにイオンがあります。 それらは、単純なイオンNa +、Cl - 、および複雑なSO 4 2-、OH - の両方に関連付けることができるイオン結合を持つ物質によって形成されます。 その結果、金属の塩、一部の酸化物および水酸化物は、イオン結晶格子を持っています。 たとえば、塩化ナトリウムの結晶は正の Na + イオンと負の Cl - イオンが交互に並んだもので、立方体の格子を形成します。 このような結晶内のイオン間の結合は非常に安定しています。 したがって、イオン格子を持つ物質は、比較的高い硬度と強度を特徴とし、耐火性と不揮発性です。
結晶格子 - a) およびアモルファス格子 - b)。
 結晶格子 - a) およびアモルファス格子 - b)。
結晶格子 - a) およびアモルファス格子 - b)。 原子結晶格子
原子力結晶格子と呼ばれ、そのノードには個々の原子があります。 そのような格子では、原子は互いに接続されています 非常に強い共有結合. このタイプの結晶格子を持つ物質の例は、炭素の同素変態の 1 つであるダイヤモンドです。 原子結晶格子を持つほとんどの物質は非常に高い融点を持ち(たとえば、ダイヤモンドでは3500°Cを超えています)、それらは強くて硬く、実質的に不溶です。


分子結晶格子
分子結晶格子と呼ばれ、そのノードに分子が配置されています。 これらの分子の化学結合には、極性 (HCl、H 2 O) と非極性 (N 2 、O 2) の両方があります。 分子内の原子は非常に強力な共有結合で結ばれているにもかかわらず、 分子間引力の弱い力が分子自体の間に作用する. したがって、分子結晶格子を持つ物質は硬度が低く、融点が低く、揮発性があります。 ほとんどの固体有機化合物は、分子結晶格子 (ナフタレン、グルコース、糖) を持っています。
 分子結晶格子 (二酸化炭素)
分子結晶格子 (二酸化炭素) 金属結晶格子
を含む物質 金属結合金属結晶格子を持っています。 そのような格子の節では 原子とイオン(金属原子が容易に変化する原子またはイオンのいずれか) このような金属の内部構造は、展性、可塑性、電気および熱伝導性、特徴的な金属光沢など、金属の特徴的な物理的特性を決定します。

カンニングペーパー


USEコードのトピック:分子および非分子構造の物質。 結晶格子の種類。 物質の特性がその組成と構造に依存すること。
分子動力学理論
すべての分子は、原子と呼ばれる小さな粒子で構成されています。 すべてオープン 現在原子は周期表にまとめられています。
原子それを保持する物質の最小の、化学的に分割できない粒子です 化学的特性. 原子同士がつながる 化学結合. 以前に検討しました。 この記事を読む前に、化学結合の種類に関する理論を必ず勉強してください!
では、粒子が物質中でどのように結合するかを見てみましょう。
粒子同士の相対的な位置に応じて、粒子が形成する物質の特性は大きく異なります。 したがって、粒子が互いに離れている場合 遠い(粒子間の距離はかなり より多くのサイズ粒子自体)、実際には互いに相互作用せず、空間内をランダムかつ継続的に移動します。 ガス .
粒子が見つかった場合 近いお互いですが、 無秩序に、 もっと 相互に作用する、ある位置で激しい振動運動を行いますが、別の位置にジャンプすることができます。これは構造のモデルです 液体 .
粒子が見つかった場合 近いお互いに、しかしもっと 整然とした、 と もっと交流するしかし、実際には他の平衡位置に移動することなく、1 つの平衡位置内でのみ移動します。 位置、私たちは扱っています 個体 .

ほとんどの既知の化学物質と混合物は、固体、液体、気体の状態で存在できます。 最も簡単な例は 水. 通常の状態では、 液体、0 o Cで凍結します-液体状態から 個体、そして100°Cで沸騰します-入ります 気相- 水蒸気。 同時に、通常の状態での多くの物質は、気体、液体、または固体です。 たとえば、窒素と酸素の混合物である空気は、通常の状態では気体です。 しかし、 高圧そして低温、窒素および酸素は凝縮し、液相に入ります。 液体窒素は産業で積極的に使用されています。 時々孤立 プラズマ、 と 液晶、別々のフェーズとして。

個々の物質と混合物の多くの特性は、 互いに対する空間内の粒子の相互配置!
この記事では、 固体の特性、それらの構造に応じて。 固体の基本的な物性: 融点、電気伝導率、熱伝導率、機械的強度、可塑性など
融点 物質が固体から液体に、またはその逆に変化する温度です。

壊れずに変形する物質の能力です。

電気伝導性 電流を伝導する物質の能力です。
電流は荷電粒子の規則的な動きです. したがって、電流は、存在する物質によってのみ伝導できます。 荷電粒子の移動. 電流を伝導する能力に応じて、物質は導体と誘電体に分けられます。 導体は、電流を伝導できる物質です (つまり、可動荷電粒子を含みます)。 誘電体は実質的に電流を通さない物質です。

固体では、物質の粒子を見つけることができます 無秩序に、 また より整然とした O. 固体の粒子が空間にある場合 無秩序に、物質は呼ばれます まとまりのない. アモルファス物質の例 - 石炭、雲母ガラス.

固体の粒子が規則的に空間に配置されている場合、つまり 三次元の幾何学的構造を繰り返す形、そのような物質は呼ばれます 結晶、および構造自体 結晶格子 . 私たちが知っている物質のほとんどは結晶です。 粒子自体は ノード結晶格子。
結晶性物質は、特に次の点で区別されます。 粒子間の化学結合の種類 結晶中 - 原子、分子、金属、イオン; 結晶格子の最も単純なセルの幾何学的形状によると - 立方体、六角形など
に応じて 結晶格子を形成する粒子の種類 、 区別 原子、分子、イオン、金属の結晶構造 .
原子結晶格子

原子結晶格子は、存在するときに形成されます。 原子. 原子は互いにつながっている 共有化学結合. したがって、そのような結晶格子は非常に 耐久性のある、それを破壊するのは簡単ではありません。 原子結晶格子は、原子価の高い原子によって形成されます。 隣接する原子との結合が多数 (4 つ以上) あります。 原則として、これらは非金属です: 単体 - ケイ素、ホウ素、炭素(ダイヤモンド、グラファイトの同素体変態)、およびそれらの化合物(ホウ素炭素、酸化ケイ素(IV)など).)。 非金属間では主に共有化学結合が起こるため、 自由電子(および他の荷電粒子) 原子結晶格子を持つ物質 ほとんどの場合、いいえ. したがって、これらの物質は通常 パフォーマンスが非常に悪い 電気、つまり 誘電体です. これらは一般的なパターンであり、いくつかの例外があります。

粒子間の通信 原子結晶中: .
水晶の節で 原子結晶構造を整えた 原子.
相状態 通常の状態での原子結晶:原則として、 固体.
物質、固体状態で原子結晶を形成します。
- 単体物質 高原子価 (周期表の真ん中にあります): ホウ素、炭素、シリコンなど
- これらの非金属によって形成される複合物質:シリカ(酸化ケイ素、 石英砂) SiO 2 ; 炭化ケイ素(コランダム)SiC; 炭化ホウ素、窒化ホウ素など
原子結晶格子を持つ物質の物理的性質:
— 強さ;
- 耐火性(高融点);
- 導電率が低い。
- 熱伝導率が低い。
— 化学的不活性(不活性物質);
- 溶剤不溶性。

分子結晶格子ノードが 分子. 分子を結晶に保持する 分子間引力の弱い力 (ファンデルワールス軍、水素結合、または静電引力)。 したがって、そのような結晶格子は、原則として、 破壊するのはかなり簡単. 分子結晶格子を持つ物質 - もろい、もろい. 分子間の引力が大きいほど、物質の融点は高くなります. 原則として、分子結晶格子を持つ物質の融点は200〜300Kを超えません。 したがって、通常の状態では、分子結晶格子を持つほとんどの物質は次の形で存在します。 気体または液体. 分子結晶格子は、原則として、酸、非金属の酸化物、非金属の他の二元化合物、安定した分子を形成する単純な物質(酸素O 2、窒素N 2、水H 2 O)によって固体の形で形成されますなど)、有機物。 原則として、これらは共有極性(まれに非極性)結合を持つ物質です。 なぜなら 電子は化学結合、分子結晶格子を持つ物質に関与しています - 誘電体、熱の悪い導体.

粒子間の通信 分子結晶中: m 分子間、静電気、または分子間引力.
水晶の節で 分子結晶構造を整えた 分子.
相状態 通常の状態での分子結晶: 気体、液体、固体.
物質、固体状態で形成 分子結晶:
- 小さくて強い分子を形成する単純な非金属物質 (O 2 、N 2 、H 2 、S 8 など);
- 共有極性結合を持つ複合物質(非金属の化合物) (ケイ素とホウ素の酸化物、ケイ素と炭素の化合物を除く) - 水H 2 O、硫黄酸化物SO 3など
- 単原子希ガス (ヘリウム、ネオン、アルゴン、クリプトン や。。など。);
- 多数 有機物、イオン結合がない — メタンCH 4、ベンゼンC 6 H 6など
物理的特性 分子結晶格子を持つ物質:
・融着性(低融点):
— 高い圧縮率;
- 溶液や溶融物と同様に、固体の分子結晶は電流を伝導しません。
- 通常の状態での相状態 - 気体、液体、固体。
- 高いボラティリティ;
- 低硬度。
イオン結晶格子

結晶の節に荷電粒子がある場合 - イオン、私たちは話すことができます イオン結晶格子 . 原則として、イオン結晶が交互に 陽イオン(陽イオン) および マイナスイオン(陰イオン)なので、結晶中の粒子が保持されます 静電引力 . 結晶の種類と結晶を形成するイオンの種類に応じて、そのような物質は次のようになります。 かなり強くてタフ. 固体状態では、原則として、イオン結晶内に可動荷電粒子はありません。 しかし、結晶が溶解または融解すると、イオンが放出され、外部の作用で移動できます。 電界. それらの。 電流のみの溶液または溶融物を伝導するイオン結晶。 イオン結晶格子は、 イオン化学結合. 例そのような物質 塩塩化ナトリウム 炭酸カルシウム- CaCO 3など イオン結晶格子は、原則として固相で形成されます 塩、塩基、金属酸化物、金属と非金属の二元化合物.

粒子間の通信 イオン結晶で: .
水晶の節で イオン格子で イオン.
相状態 通常の状態でのイオン結晶: 通常 固体.
化学物質 イオン結晶格子を持つ:
- アンモニウム塩を含む塩(有機および無機) (例えば、 塩化アンモニウム NH4Cl);
- 根拠;
- 金属酸化物;
- 金属と非金属を含む二元化合物。
イオン結晶構造を持つ物質の物性:
- 高融点(耐火性);
- イオン結晶の溶液と溶融物 - 電流導体;
- ほとんどの化合物は極性溶媒 (水) に可溶です。
- 通常の条件下では、ほとんどの化合物が固相状態です。

そして最後に、金属は特別なタイプの空間構造によって特徴付けられます - 金属結晶格子、これは期限です 金属化学結合 . 金属原子はかなり弱く保持します 価電子. 金属によって形成された結晶では、次のプロセスが同時に発生します。 一部の原子は電子を供与し、正に帯電したイオンになります; これらは 電子は結晶内をランダムに移動します; 一部の電子はイオンに引き寄せられます. これらのプロセスは同時にランダムに発生します。 したがって、 イオンが現れる 、イオン結合の形成のように、 共通電子が形成される 教育のように 共有結合. 自由電子は、気体のように、結晶の体積全体をランダムかつ連続的に移動します。 したがって、彼らは時々呼ばれます 電子ガス "。 多数の可動荷電粒子が存在するため、金属 電気、熱を通す. 金属の融点は大きく異なります。 金属にも特徴があります 独特の金属光沢、展性、つまり 強い機械的ストレスの下で破壊することなく形状を変える能力, tk. 化学結合は壊れていません。

粒子間の通信 : .
水晶の節で 金属格子付き 金属イオンと原子.
相状態 通常の条件下での金属: 通常は固体(例外 - 水銀、通常の状態では液体)。
化学物質 金属結晶格子を持つ - 単体 - 金属.
金属結晶格子を持つ物質の物理的性質:
– 高い熱伝導率と電気伝導率;
- 可鍛性と可塑性;
- 金属光沢;
- 金属は一般に溶剤に溶けません。
ほとんどの金属は通常の状態では固体です。
結晶格子の異なる物質の物性比較
結晶格子のタイプ(または結晶格子の不在)により、物質の基本的な物理的特性を評価することができます。 典型的な大まかな比較のために 物理的特性異なる結晶格子を持つ化合物を使用するのは非常に便利です 化学物質と 特徴的な性質. たとえば、分子格子の場合、 二酸化炭素、原子結晶格子の場合 - ダイヤモンド、金属用 - 銅、およびイオン結晶格子の場合 - 塩, 塩化ナトリウム塩化ナトリウム。

生成する単体構造のまとめ表 化学元素周期表の主要なサブグループから(二次サブグループの元素は金属であるため、金属の結晶格子を持っています)。

構造を持つ物質の特性の関係の最終表: