どの形容詞が非金属の特性を反映しているか. 非金属。 一般的な特性。 原子の構造。 物理的特性
>> 化学: 単体 - 非金属
非金属 - これらは、金属の物理的性質を持たない自由な形の単純な物質を形成する化学元素です。 109のうち 化学元素 87 は金属、22 は非金属です。
6. 単純物質の金属と非金属への分割の相対性。
個々の貴金属の名前の語源を考えてみましょう。
「空気中に雷の匂いがした」という詩的な表現が化学的に正しくないのはなぜですか?
Na2、Br2、O2、N2 という分子の形成スキームを書き留めます。 これらの分子の結合の種類は何ですか?
レッスン内容 レッスン概要サポート フレーム レッスン プレゼンテーション アクセラレーション メソッド インタラクティブ テクノロジー 練習 タスクと演習 自己検査 ワークショップ、トレーニング、ケース、クエスト 宿題 ディスカッション 質問 修辞的な質問学生から イラスト オーディオ、ビデオ クリップ、マルチメディア写真、絵、図表、スキーム、ユーモア、逸話、ジョーク、漫画のたとえ話、ことわざ、クロスワード パズル、引用 アドオン 抄録記事 好奇心旺盛なチート シートのチップ 教科書 基本および追加の用語集 その他 教科書と授業の改善教科書の間違いを正す教科書の断片を更新する レッスンのイノベーションの要素 古い知識を新しい知識に置き換える 教師のみ 完璧なレッスン年間カレンダー計画 討論プログラムの方法論的推奨事項 統合されたレッスン- これは、化学結合を分極し、共通の電子対をそれ自体に向かって引き寄せる能力です。
22 元素は非金属に分類されます。
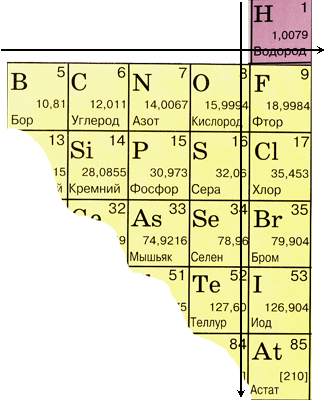
化学元素の周期表における非金属元素の位置
| グループ | 私 | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | VIII |
| 1期 | H | 彼 | |||||
| 2期 | の | と | N | 〇 | ふ | ねえ | |
| 3期 | シ | P | S | CL | Ar | ||
| 4期 | として | セ | Br | KR | |||
| 5期 | テ | 私 | セ | ||||
| 6期 | で | Rn |
非金属の原子の構造
非金属の特徴は、それらの原子の外部エネルギーレベルでの(金属と比較して)電子の数が多いことです。 これは、追加の電子を追加し、金属よりも高い酸化活性を示す能力が高いことを決定します。 特に強力な酸化特性、つまり電子を結合する能力は、VI-VII 族の第 2 および第 3 周期にある非金属によって示されます。 フッ素や塩素などのハロゲン原子の軌道上の電子の配置を比べてみると、それぞれの特徴を判断することもできます。 フッ素原子には自由軌道がありません。 したがって、フッ素原子は原子価 I と酸化状態 - 1 しか表示できません。最も強い酸化剤は フッ素. 他のハロゲンの原子、たとえば塩素原子には、同じエネルギー準位に自由な d 軌道があります。 このため、電子のデペアリングは 3 つの異なる方法で発生する可能性があります。 最初のケースでは、塩素は+3の酸化状態を示し、塩-亜塩素酸塩、例えば亜塩素酸カリウムKClO 2に対応する塩酸HClO 2を形成することができます。 2番目のケースでは、塩素は塩素の酸化状態が+5である化合物を形成する可能性があります。 このような化合物には、塩素酸HClO 3 およびその塩、塩素酸塩、例えば、塩素酸カリウムKClO 3 (ベルトレ塩)が含まれる。 3 番目のケースでは、塩素は、たとえば過塩素酸 HClO 4 およびその塩、過塩素酸塩 (過塩素酸カリウム KClO 4) では +7 の酸化状態を示します。非金属分子の構造。 非金属の物性
気体状態で 室温それは:· 水素 - H 2;
· 窒素、N 2 ;
· 酸素 - O 2;
· フッ素 - F 2;
· 塩素 - CI 2。
不活性ガス:· ヘリウム - 彼;
· ネオン - Ne;
· アルゴン - Ar;
· クリプトン、Kr;
· キセノン - Xe;
· ラドン - Rn)。
の 液体- 臭素 - Br.の 個体:
テルル - Te;
· ヨウ素 - 私;
· アスタチン - At。
非金属には、リンの赤、臭素の茶色、硫黄の黄色、塩素の黄緑色、ヨウ素蒸気の紫など、はるかに豊富な色のスペクトルがあります。最も典型的な非金属は分子構造を持っていますが、あまり典型的でないものは非分子構造を持っています。 これは、それらの特性の違いを説明しています。
単体の組成と性質 - 非金属
非金属は、単原子分子と 2 原子分子の両方を形成します。 に 単原子 非金属には、最も活性な物質でも実質的に反応しない不活性ガスが含まれます。 不活性ガスは周期系の第VIII族に位置し、対応する単純な物質の化学式は次のとおりです:He、Ne、Ar、Kr、Xe、およびRn。
一部の非金属フォーム 二原子 分子。 これらは、H 2、F 2、Cl 2、Br 2、Cl 2(周期系のVII族の元素)、ならびに酸素O 2および窒素N 2です。 から 三原子 分子はオゾンガス (O 3) で構成されています。 固体である非金属の物質は、化学式を作るのがかなり難しいです。 グラファイトの炭素原子は、さまざまな方法で互いに接続されています。 与えられた構造で個々の分子を分離することは困難です。 そのような物質の化学式を書くとき、金属の場合のように、そのような物質は原子だけで構成されているという仮定が導入されます。 同時に、化学式は指数なしで書かれています:C、Si、Sなど。オゾンや酸素などの単純な物質で、定性的組成は同じですが(どちらも同じ元素 - 酸素で構成されています)、原子数が異なります分子の中にはさまざまな性質があります。 つまり、酸素にはにおいがありませんが、オゾンには雷雨のときに感じる刺激的なにおいがあります。 固体の非金属、グラファイト、ダイヤモンドの特性。これらも定性的組成は同じですが、 異なる構造、大きく異なります(グラファイトは脆く、ダイヤモンドは硬い)。 このように、物質の特性は、その質的な組成だけでなく、物質分子に含まれる原子の数とそれらがどのように相互接続されているかによっても決定されます。 単体の形の非金属は、固体または気体の状態にあります(臭素を除く - 液体)。 それらは金属の物理的性質を持っていません。 固体の非金属は、金属の特徴的な光沢を持たず、通常はもろく、よく伝導しません。 電気および熱(グラファイトを除く)。 結晶性ホウ素 B (結晶性シリコンと同様) は、非常に高い融点 (2075°C) と高い硬度を持っています。 ホウ素の電気伝導率は、温度の上昇とともに大幅に増加するため、半導体技術で広く使用することができます。 鋼やアルミニウム、銅、ニッケルなどの合金にホウ素を添加すると、それらの機械的特性が向上します。 ホウ化物(ホウ素とチタンなどの金属との化合物:TiB、TiB 2)は、ジェットエンジン部品、ガスタービンブレードの製造に必要です。 スキーム 1 からわかるように、炭素は C、シリコンは Si、ホウ素は B は類似の構造を持ち、いくつかの共通の特性を持っています。 単純な物質として、それらは結晶性と非晶質の2つの変形で発生します。 これらの元素の結晶変態は非常に硬く、融点が高くなります。 結晶シリコンは半導体の性質を持っています。 これらすべての元素は、炭化物、ケイ化物、ホウ化物(CaC 2 、Al 4 C 3 、Fe 3 C、Mg 2 Si、TiB、TiB 2)などの金属と化合物を形成します。 それらのいくつかは、Fe 3 C、TiBなど、より硬度が高いです。 炭化カルシウムは、アセチレンの製造に使用されます。
非金属は、金属の物理的特性を持たない自由な形の単純な物質を形成する化学元素です。 114 の化学元素のうち、92 は金属、22 は非金属です。 非金属は単純な物質であり、通常の状態では、気体、液体、固体である可能性があります (図 46)。
米。 46.
単体 - 非金属
室内実験その6
非金属のコレクションとの知り合い
非金属のコレクションをご覧ください。 与えられた非金属の化学式を書き留め、昇順に並べ替えます。
- 密度;
- 硬度;
- 輝く;
- 色の変化の強さ。
タスクを完了するには、追加の情報源である付録 1 と 2 を使用してください。
ガスは、ヘリウム He、ネオン Ne、アルゴン Ar、クリプトン Kr、キセノン Xe、ラドン Rn です。 それらは不活性ガスと呼ばれます。 不活性ガスの分子は、1 つの原子で構成されています。 外側の電子層では、不活性ガスの原子 (ヘリウムを除く) は 8 個の電子を持っています。 ヘリウムは2つ。 化学的安定性において、不活性ガスは貴金属(金とプラチナ)に似ており、2番目の名前である希ガスがあります。 この名前は、不活性ガスに適していますが、それでも時々侵入します 化学反応そして化合物を形成します。 1962年、キセノンとフッ素の化合物が得られたというメッセージが表示されました。 現在、キセノン、クリプトン、ラドンとフッ素、酸素、塩素、窒素との 150 を超える化合物が知られています。
希ガスの化学的排他性の考えはあまり一貫していないことが判明したため、想定されるゼログループの代わりに、D. I. Mendeleevの表のグループVIII(グループVIIIA)に不活性ガスが配置されました。
ヘリウムは、水素に次ぐ軽さですが、後者とは異なり、不燃性です。つまり、火災の危険がなく、気球や飛行船で満たされています(図47)。

米。 47.
風船そして飛行船はヘリウムで満たされています
ネオンは照明付き広告の製造に使用されます (図 48)。 「街の通りはネオンで溢れていた」という比喩的な表現を思い出してください。

水素、酸素、窒素、塩素、フッ素のガスは、それぞれ H 2、O 2、N 2、Cl 2、F 2 の二原子分子を形成します。
物質の組成は、化学記号と数字 - インデックス、化学式を使用して書面で表されます。 化学式によると、ご存知のように、物質の相対分子量 (Mr) が計算されます。 単体の相対分子量は相対分子量の積に等しい 原子質量酸素O 2など、分子内の原子の数について:
Mr(02) = Ar(0) × 2 = 16 × 2 = 32.
しかし、元素酸素は別のガス状の単体物質であるオゾンを形成し、その分子にはすでに 3 つの酸素原子が含まれています。 化学式オゾン 0 3、およびその相対分子量: Mr (03) = 16 × 3 = 48.
化学元素酸素の同素体修飾の特性 - 酸素O 2とオゾンO 3の単純な物質 - は異なります。 酸素は無臭ですが、オゾンはにおいがします (そのため、オゾンはギリシャ語で「におい」を意味します)。 放電の結果として空気中に少量のオゾンが形成されるため、このにおい、つまり新鮮な香りは、雷雨の際に感じることができます。
酸素は無色の気体ですが、オゾンは薄紫色をしています。 オゾンは酸素よりも殺菌性が高い(lat. qidao - 殺す)。 そのため、オゾンは消毒に使用されます 水を飲んでいる. オゾンは、地球上のすべての生命に有害な太陽スペクトルの紫外線を保持することができるため、高度 20 ~ 35 km の大気中にあるオゾン層が地球上の生命を保護しています (図 49)。人工衛星地球を使用して宇宙から撮影された写真が表示されます。大気中の低オゾン領域 (「オゾン ホール」) は白で示されています)。
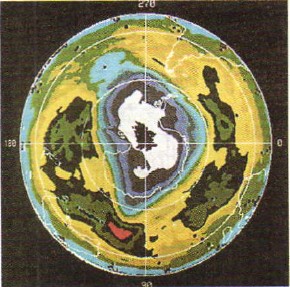
米。 49.
地球大気中の「オゾンホール」
通常の状態では非金属である単純な物質のうち、臭素だけが液体であり、その分子は二原子です。 臭素の化学式は Br 2 です。 こちらは濃いめのブラウン 悪臭液体(したがって、ブロモスは古代ギリシャ語から「臭い」と訳されているため、名前が付けられました)。
いくつかの固体物質-非金属は古くから知られています-これらは硫黄と炭素です(木炭、ダイヤモンド、グラファイトの形で)。
固体 - 非金属では、同素体の現象も観察されます。 したがって、元素炭素は非常に異なる形を形成します 外観ダイヤモンド、グラファイトなどの単純な物質 (図 50)。 ダイヤモンドとグラファイトの性質の違いの理由は構造 結晶格子これらの物質については、後で検討します。
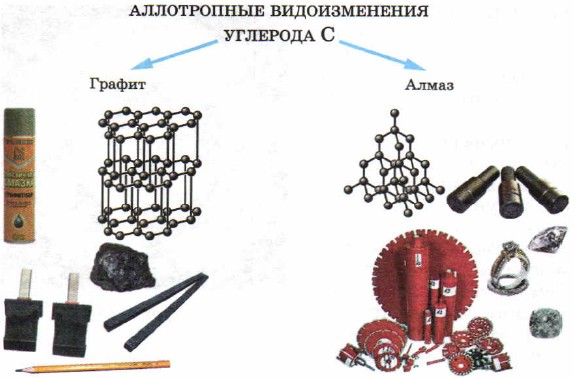
米。 50。
炭素の同素体修飾とその応用
元素のリンには 2 つの同素体修飾があります: 赤リン (それらは側面を覆っています) マッチ箱)と白リン。 後者は4原子分子を持ち、その組成は式P 4 によって反映されます。
固体物質 - 非金属は、二原子分子 I 2 を持つ結晶ヨウ素です。 ヨウ素のアルコール溶液と混同しないでください。これは、すべての家庭用応急処置キットで入手できるヨウ素チンキです。
結晶ヨウ素とグラファイトは、他の単純な物質とは異なり、非金属であり、金属光沢を持っています。
物理的性質に基づく単純物質の金属と非金属への分割の相対性を示すために、化学元素スズ Sn の同素体を考えてみましょう。 室温では、ベータスズ (β-Sn) が通常存在します。 これは、よく知られている白いスズです。これは、スズ兵が鋳造されていた金属です (図 51、a) (H. K. アンダーセンのおとぎ話を「The Steadfast Tin Soldier」を思い出してください)。 スズはブリキ缶の内側にコーティングされています(図51、b)。 これは、青銅やはんだなどのよく知られた合金の一部です(図51、c)。

米。 51.
錫の用途:
a - おもちゃ; b - 缶の生産; c - はんだ
+13.2°C未満の温度では、アルファスズ(α-Sn)はより安定しています - むしろ非金属の特性を持つ灰色の微粒子粉末です。 白いスズを灰色に変えるプロセスは、-33°Cに等しい温度で最も速くなります. この変化は比喩的な名前「スズペスト」を受け取りました。
表 3 を使用して、金属と非金属の単体を比較してみましょう。
表 3
単体物質

キーワードとフレーズ
- 希ガス。
- 同素体および同素体修飾、または修飾。
- 酸素とオゾン。
- ダイヤモンドとグラファイト。
- リン赤と白。
- 白とグレーの缶。
- 単体の金属と非金属への分割の相対性。
コンピュータで作業する
- に話す 電子申請. レッスンの内容を学習し、提案されたタスクを完了します。
- オンラインで検索 メールアドレス、段落のキーワードとフレーズの内容を明らかにする追加のソースとして機能します。 新しいレッスンを準備する際に教師にあなたの助けを提供してください - 次の段落のキーワードとフレーズについてレポートを作成してください。
質問とタスク
- 個々の希ガスの名前の語源を考えてみましょう。
- 「空気中に雷の匂いがした」という詩的表現が化学的に正しくないのはなぜですか?
- 分子の形成スキームを書き留めます:Na 2、Br 2、O 2、N 2。 タイプは何ですか 化学結合これらの分子で?
- 金属水素にはどのような化学結合が必要ですか?
- 極地探検家 R. スコットの 1912 年の南極への遠征は、燃料の供給をすべて失ったという事実のために失敗に終わりました。 この背後にある化学プロセスは何ですか?
講義 3. 非金属
1. 一般的な特性非金属元素
非金属の化学元素は 16 種類しかありませんが、そのうちの 2 つである酸素とケイ素は、地球の地殻の質量の 76% を占めています。 非金属は、植物の質量の 98.5%、人間の質量の 97.6% を占めています。 炭素、水素、酸素、硫黄、リン、窒素はすべて 有機物それらは生命の要素です。 水素とヘリウムは宇宙の主要な要素であり、太陽を含むすべての宇宙物体はそれらで構成されています。 非金属化合物なしで私たちの生活を想像することは不可能です。 化合物水は水素と酸素からできています。
非金属は、原子が電子を受け取って外部エネルギー準位を完成させ、負に帯電したイオンを形成する化学元素です。
ほとんどすべての非金属の半径は比較的小さく、 大きな数 4から7の外部エネルギー準位にある電子は、電気陰性度と酸化特性の高い値によって特徴付けられます。
1.1。 メンデレーエフの化学元素周期表における非金属元素の位置
周期系でホウ素からアスタチンに対角線を引くと、非金属元素は右の対角線上に位置し、金属は左下に位置し、これらにはすべての側亜族、ランタニド、アクチニドの元素も含まれます。 ベリリウム、アルミニウム、チタン、ゲルマニウム、アンチモンなどの対角線近くにある元素は、二重の性質を持ち、半金属です。 非金属元素: s 元素 - 水素; 13族のp元素 - ホウ素; 14 グループ - 炭素とシリコン。 グループ15 - 窒素、リン、ヒ素、グループ16 - 酸素、硫黄、セレン、テルル、およびグループ17のすべての元素 - フッ素、塩素、臭素、ヨウ素、アスタチン。 18族の元素 - 不活性ガスは特別な位置を占め、完全に完成した外側の電子層を持ち、金属と非金属の中間の位置を占めます。 それらは非金属と呼ばれることもありますが、正式には物理的特性によるものです。
1.2. 非金属元素の電子構造
外部エネルギーレベルのほとんどすべての非金属元素は、4から7までの多数の電子を持っています。ホウ素元素はアルミニウムの類似体であり、外部エネルギーレベルに3つの電子しかありませんが、半径は小さく、電子をしっかりと保持し、非金属の性質を持っています。 特に水素の電子構造に注目してみましょう。 s元素ですが、電子を1個受け取りやすく、水素化物イオンを形成し、金属の酸化力を発揮します。
非金属元素の価電子の電子配置を表に示します。
1.3。 非金属元素の性質変化のパターン
同時期同族に属する非金属元素の性質の変化のパターンを、原子の構造から考えてみましょう。
期間中:
核電荷が増える
原子の半径が小さくなる
外側のエネルギー準位にある電子の数が増え、
電気陰性度が上がる
酸化力が高まり、
非金属特性が強化されます。
グループで:
核電荷が増える
原子の半径が大きくなる
外エネルギー準位の電子数は変わらず、
電気陰性度が下がる
酸化力が弱くなり、
非金属特性が弱まります。
したがって、周期系の元素が右に高くなるほど、その非金属特性がより顕著になります。