水酸化ナトリウムの化学的性質。 水酸化ナトリウムの取得
応用 苛性ソーダ脂肪やその他の有機汚染物質を中和するというその特性の1つにより、日常生活で。 民間部門の下水道の清掃に対処するのに役立つのは、汚れや有機物の蓄積による閉塞を解消する能力です。 アパート. また、家庭で手作り石けんを作るのにも、苛性ソーダ(苛性ソーダ、水酸化ナトリウム、苛性ソーダ)が使われています。
排水管や下水道の清掃
洗面台、風呂またはシャワーの排水管、および民家のトイレまたは下水道システムを掃除するには2つの方法があります。 1つ目は、民家の下水道システムの排水管の清掃に適しています。2つ目は、高層ビルのサイフォンと排水ライザーの清掃に適しています。 使用説明書、第 1 オプション:
- 2kgの苛性ソーダを注ぐ 冷水(4 リットル);
- 得られた溶液は下水道に注がれます。
- 約1時間、水を排出することは望ましくありません。このとき、苛性ソーダは脂肪やその他の有機物を分解します。
- 1時間後、85〜90℃の水(12〜15リットル)を注ぎます。
定期的なクリーニングで 下水道管この方法では、食品残渣やその他の生物学的物質の分解によって現れるパイプからの不快な臭いが家にないことが保証されます。 使用説明書、第 2 の方法:
- シンクまたはバスの首に最大150 gの苛性ソーダが注がれます。
- 次に、最大2リットルのお湯を粉末に注意深く注ぎます。
- 5〜10分後、再びお湯を注ぎます。
- 約1時間、首に水が入らないようにしてください。
苛性ソーダは、パイプを酸性物質で洗浄した後に使用して、攻撃的な影響を中和することができます.

ポット洗浄
水酸化ナトリウムは脂肪質汚染物質によく対処するので、鍋やその他の台所用品に使用されます. このアプリケーションは、アルミニウムまたはテフロン製の皿には適していないことに注意してください。 エナメル、鋳鉄、 スチールパンそれを完璧にします。 このような手順には、次のことが必要です。
- 大きなものへ 金属製の容器水を注ぐ(少なくとも10リットル);
- 苛性ソーダ(200 g)を注ぎます。
- すりおろした洗濯石鹸を1本追加します。
- 150 gの事務用接着剤(液体ガラス)を注ぎます。
- すべてをよく混ぜて、得られた混合物に皿を入れます。
- 沸騰させ、さらに2時間弱火に保ちます。
- 洗った食器を取り出してよく洗う 流れる水.
同様に、あなたは対処することができます 古い脂肪プレートでは、沸騰時間だけが10分に短縮されます。

石鹸作り
苛性アルカリは別の分野で使用されます - 石鹸の製造。 苛性ソーダは石鹸の組成の主成分であるため、その使用は必須です。
- 苛性ソーダ;
- 植物油;
- エッセンシャルオイル;
- 精製(蒸留)水。
比率が異なり、特定の材料を追加する石鹸のレシピはたくさんありますが (これが石鹸作りの秘訣です)、基本的な材料を使用して、実験して独自の石鹸を作ることができます。 これを行うには、苛性アルカリを水と混ぜ合わせ、植物油とエッセンシャルオイルを溶液に入れます。 均一な塊が得られるまで成分を混合した後、型に注ぎ、日中に固化させます。
美容目的では、精製度の高い苛性ソーダが必要です。 ソープショップで購入できます。

苛性ソーダの保管と注意事項
自宅で苛性ソーダを適切に保管する方法を理解するには、それが何であるかを知る必要があります. 苛性ソーダとは? まず、これ 化学物質・やけどの原因となる強アルカリ。 したがって、溶液と粉末の両方を、適切なラベルが付いた密閉容器に入れて、子供の手の届かないところに保管する必要があります。 また、苛性は可燃性および爆発性の物質を指すため、加熱装置や直火源から遠ざける必要があります。
苛性ソーダは気密容器に保管されます。粉末は紙袋またはポリエチレン缶に、液体はゴム栓付きの高密度ポリエチレン製の容器に保管されます。 液剤、顆粒剤ともに賞味期限は12ヶ月です。 自己調製した 3% 溶液も最大 12 か月間保存できますが、使用前に沈殿物が形成されていないか確認する必要があります。 溶液中にフレークが見られる場合は、炭酸カリウムへの変換が発生し、その特性が失われている可能性があります。 コンテナの透明度または不透明度は、コースティクスのプロパティにはまったく影響しません。
水酸化ナトリウムを扱うときは、次の注意事項を守る必要があります。
- ゴム手袋で作業します。
- 目や粘膜を化学物質の侵入から保護します。
- 侵入を防ぎます。
苛性ソーダが皮膚に付着した場合は、すぐに流水で洗い流してください。 誤って摂取したり目に入ったりした場合は、深刻な視覚障害 (角膜組織の死) を引き起こしたり、喉頭や食道、胃を火傷する可能性があるため、直ちに医師に相談することをお勧めします。

その他の事実
日常生活の苛性は他の目的に使用されます。
- 家畜に危険な感染症が発生した場合の補助農場の消毒のために、施設は苛性ソーダの4%溶液で処理されます。 処理の間、動物は取り除かれます。
- 金属表面の錆を酸で洗浄する場合、腐食剤が不動態化の主成分です。 酸溶液で処理した後、金属はホルマリン、苛性ソーダ、アンモニウム、および水の混合物で処理されます。
- 衣類の頑固な油汚れの落としに。 2%水酸化ナトリウム溶液(大さじ1)を加えて、物を水に2時間浸します。 水1リットルあたりスプーン。 その後、それらは消去されます 通常の方法で. 手洗いの場合はゴム手袋を着用してください。
注意!
苛性ソーダで汚れを落とす方法は、シルクやウールの生地には適していません。 10% の苛性溶液では、残留物なしで溶解しますが、濃度が低くても、これらの組織に重大な損傷を引き起こします。
序章 .
水酸化ナトリウムまたは苛性ソーダ (NaOH)、塩素、塩酸 HCl、および水素は、現在、塩化ナトリウム溶液の電気分解によって産業界で製造されています。
苛性ソーダまたは水酸化ナトリウム - 一般に苛性ソーダと呼ばれる強アルカリは、石鹸の製造、アルミナの製造に使用されます - アルミニウム金属の製造、塗料およびワニス、石油精製産業の製造における中間生成物有機合成産業および国民経済の他の部門におけるレーヨンの。
塩素、塩化水素、塩酸、苛性ソーダを扱う場合は、安全規則に厳密に従う必要があります。塩素を吸入すると、激しい咳と窒息、気道の粘膜の炎症、肺水腫、そしてその後肺における炎症性病巣の形成。
塩化水素は、空気中の低レベルであっても、鼻や喉頭の刺激、胸のうずき、声枯れ、窒息を引き起こします。 低濃度の慢性中毒では、歯が特に影響を受け、そのエナメル質は急速に破壊されます。
塩酸中毒は非常に似ています と塩素中毒。
水酸化ナトリウムを製造するための化学的方法。
水酸化ナトリウムを生成するための化学的方法には、石灰質およびフェライトが含まれます。
水酸化ナトリウムを製造するための石灰法は、約80℃の温度でソーダ溶液と石灰乳との相互作用からなる. このプロセスは苛性化と呼ばれます。 それは反応によって記述されます
Na 2 CO 3 + Ca (OH) 2 \u003d 2NaOH + CaCO 3 (1)
ソリューション決済
反応(1)によれば、水酸化ナトリウム溶液と炭酸カルシウムの沈殿物が得られる。 炭酸カルシウムを溶液から分離し、蒸発させて約92%のNaOHを含む溶融生成物を得る。 溶融した NaOH を鉄製のドラム缶に注ぎ、そこで凝固させます。
フェライト法は、次の 2 つの反応で表されます。
Na 2 CO 3 + Fe 2 0 3 = Na 2 0 Fe 2 0 3 + CO 2 (2)
ナトリウムフェライト
Na 2 0 Fe 2 0 3 -f H 2 0 \u003d 2 NaOH + Fe 2 O 3 (3)
溶液沈殿
反応 (2) は焼結プロセスを示します ソーダ灰 1100-1200°Cの温度で酸化鉄と。 この場合、スペック - フェライト ナトリウムが形成され、二酸化炭素が放出されます。 次に、ケークは反応(3)に従って水で処理(浸出)される。 水酸化ナトリウムの溶液とFe 2 O 3 の沈殿物が得られ、それを溶液から分離した後、プロセスに戻す。 この溶液には、約 400 g/l の NaOH が含まれています。 それを蒸発させて、約92%のNaOHを含有する生成物を得る。
水酸化ナトリウムを製造するための化学的方法には、大量の燃料を消費する、得られる苛性ソーダが不純物で汚染される、装置のメンテナンスが面倒であるなどの重大な欠点があります。方法。
電気分解および電気化学プロセスの概念。
電気化学プロセスは、定数の作用下で水溶液または溶融物で発生する化学プロセスと呼ばれます 電流.
電解質と呼ばれる塩の溶液と溶融物、酸とアルカリの溶液は、電流の移動がイオンによって行われる第2の種類の導体です。 (金属などの第 1 種の導体では、電流は電子によって運ばれます。) 電流が電解質を通過すると、電極でイオンが放出され、対応する物質が放出されます。 このプロセスは電気分解と呼ばれます。 電気分解が行われる装置は、電解槽または電解槽と呼ばれます。
電気分解は、塩素、水素、酸素、アルカリなど、多くの化学製品を得るために使用されます。電気分解によって、高純度の化学製品が得られることに注意してください。 化学的方法彼らの生産。
電気化学プロセスの欠点には、電気分解中のエネルギー消費が高く、得られる製品のコストが高くなることが含まれます。 この点で、安価な電気エネルギーのみに基づいて電気化学プロセスを実行することをお勧めします。
水酸化ナトリウム製造の原料。
水酸化ナトリウム、塩素、水素の製造には、電気分解を受ける塩化ナトリウム溶液が使用されます 塩は地下堆積物の形で自然界に存在します 岩塩、湖や海の水で、天然の塩水または溶液の形で。 岩塩鉱床は、ドンバス、ウラル、シベリア、トランスコーカシアなどの地域にあります。 私たちの国といくつかの湖では塩分が豊富です。
夏になると、湖面から水が蒸発し、食塩が結晶となって落ちます。 このような塩は自家植栽と呼ばれます。 の 海水最大 35 g/l の塩化ナトリウムが含まれています。 水の蒸発が激しい暑い気候の場所では、塩化ナトリウムの濃縮溶液が形成され、そこから結晶化します。 大地の腸の中、塩の流れの層の中 地下水、NaCl を溶解し、ボアホールを通って地表に出てくる地下の塩水を形成します。
塩溶液は、どのような方法で得られたとしても、カルシウム塩とマグネシウム塩の不純物を含んでおり、電解工場に移送される前にこれらの塩から精製されます。 電気分解プロセス中に、難溶性の水酸化カルシウムと水酸化マグネシウムが形成される可能性があるため、精製が必要です。
ブラインの洗浄は、ソーダとライムミルクの溶液で行われます。 化学的精製に加えて、溶液は沈降およびろ過によって機械的不純物から解放されます。
一般的な塩溶液の電気分解は、固体の鉄 (鋼) 陰極と隔膜を備えた浴、および液体水銀陰極を備えた浴で行われます。 いずれにせよ、現代の大型塩素プラントの設備に使用される工業用電解槽には、高い生産性、シンプルな設計、コンパクトで確実かつ安定した動作が求められます。
鋼陰極とグラファイト陽極を備えた浴での塩化ナトリウム溶液の電気分解 .
1つの装置(電解槽)で水酸化ナトリウム、塩素、水素を得ることができます。 塩化ナトリウム水溶液に直流電流を流すと、塩素の放出が期待できます。
2CI - - 2位Þ С1 2 (a)
酸素と同様に:
20N - - 2位Þ 1/2O 2 + H 2 O (b)
H 2 0-2eÞ1 / 2Þ 2 + 2H +
OH - - イオンの放電の標準電極電位は + 0.41 V、塩素イオンの放電の標準電極電位は+ 1.36です V.塩化ナトリウムの中性飽和溶液では、ヒドロキシルイオンの濃度は約 1 10 - 7 g-eq/l。 25°C では、水酸化物イオンの放出の平衡電位は次のようになります。
放電の平衡電位、4.6 の溶液中の NaCl 濃度での塩化物イオン g-eq/l等しい
したがって、過電圧が小さい陽極では、まず酸素を放出する必要があります。
ただし、グラファイト アノードでは、酸素過電圧は塩素過電圧よりもはるかに高いため、主に C1 - イオンを放電し、反応 (a) に従って塩素ガスを放出します。
塩素の放出は、平衡電位の値の減少により、溶液中の NaCl の濃度が増加すると促進されます。 これが、310-315 を含む濃縮塩化ナトリウム溶液を使用する理由の 1 つです。 g/l。
アルカリ溶液中のカソードでは、水分子は次の式に従って放出されます。
H 2 0 + e \u003d H + OH - (c)
再結合後の水素原子は、分子状水素の形で放出されます
2H → H 2 (d)
固体カソード上の水溶液からのナトリウムイオンの放電は、水素に比べて放電の電位が高いため不可能です。 したがって、溶液中に残った水酸化物イオンは、ナトリウムイオンとともにアルカリ溶液を形成します。
NaCl の分解プロセスは、次の反応によってこのように表すことができます。
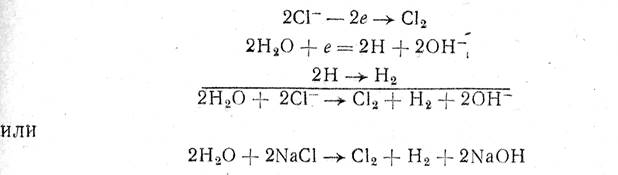
すなわち、塩素がアノードで形成され、水素と水酸化ナトリウムがカソードで形成されます。
電気分解中、説明されている主なプロセスに加えて、副次的プロセスも発生する可能性があり、その 1 つが式 (b) で表されます。 さらに、アノードで放出された塩素は、電解質に部分的に溶解し、反応によって加水分解されます。
陽極へのアルカリ(OH - イオン)の拡散または陰極と陽極生成物の置換の場合、次亜塩素酸および 塩酸アルカリで中和して、次亜塩素酸塩と塩化ナトリウムを形成します。
NOS1 + NaOH \u003d NaOCl + H 2 0
HCl + NaOH \u003d NaCl + H 2 0
陽極上のイオン ClO - は容易に ClO 3 - に酸化されます。 そのため、電気分解時の副反応で次亜塩素酸塩、塩化ナトリウム、塩素酸ナトリウムが生成され、電流効率やエネルギー効率の低下につながります。 アルカリ性環境では、陽極での酸素の放出が促進され、電解性能も低下します。
副反応の発生を抑えるためには、正極生成物と負極生成物が混合しない条件を作る必要があります。 これらには、ダイアフラムによるカソードとアノードの空間の分離、およびアノードへのOH - イオンの移動とは反対の方向にダイアフラムを通る電解質の濾過が含まれます。 このようなダイヤフラムはフィルターダイヤフラムと呼ばれ、アスベストでできています。
塩素の溶解度が低下する電解温度と電解液中の NaCl 濃度の上昇、および陰極液中の NaOH 濃度の低下により、副反応の可能性が減少します。
電解温度の上昇は、電流効率だけでなく、電解液の電気伝導度も上昇させ、それによって槽の電圧を低下させます。 したがって、温度を上げると消費量が減少します。 電気エネルギーしたがって、通常、塩化ナトリウム溶液の電気分解は70〜80°Cで行われます.
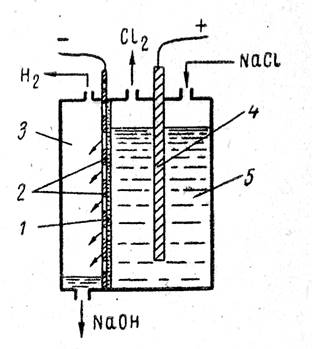
フィルタリングダイヤフラムを備えた産業用電解槽は、業界で広く使用されています。 そのようなお風呂の図を図1に示します。 1 槽には、スチール製の穴あき (穴付き) カソードとグラファイト アノードがあります。 アスベスト段ボール製のフィルターダイヤフラムがカソードにしっかりと取り付けられています。
 塩化ナトリウム溶液は陽極空間に供給され、隔膜を通してろ過され、陰極に到達します。 電解液のろ過速度は、いわゆるダイヤフラム漏れによって特徴付けられます v
(cm 3 /h)ダイヤフラムの断面積に依存します ふ
(1を参照)、電解質カラムの静水圧 時間
,
ダイヤフラムの厚さ b (cm)および電解質粘度μ。
塩化ナトリウム溶液は陽極空間に供給され、隔膜を通してろ過され、陰極に到達します。 電解液のろ過速度は、いわゆるダイヤフラム漏れによって特徴付けられます v
(cm 3 /h)ダイヤフラムの断面積に依存します ふ
(1を参照)、電解質カラムの静水圧 時間
,
ダイヤフラムの厚さ b (cm)および電解質粘度μ。 直流電流が流れると、陽極で塩素が形成され、陰極で水素とアルカリが形成され、陰極の穴を通過して陰極空間に流れ込み、浴から除去されます。
フィルターダイヤフラムを備えたバスの図:
1-ダイヤフラム; 2 - スチールカソード;
3 - 陰極空間;
4 - アノード; 5 - アノードスペース
お風呂では、食卓塩の完全な分解はなく、
アルカリと未分解の食卓塩の一定濃度が確立されます。
浴槽から流れ出る電解液には110~120が含まれています。 g/l NaOH と 180-170 g/l塩化ナトリウム。
産業用電解槽は、負荷を増やすことによって達成されるより高い生産性を備えている必要があります。 非常に発達した表面を持つ陰極の使用により、最大 50,000 の負荷を持つコンパクトな電解槽を作成することが可能になります A.この場合、ダイヤフラムは、真空を使用して塩酸アルカリ溶液中のアスベスト繊維の懸濁液から陰極表面に吸引または「堆積」されます。

米。 2.堆積したダイヤフラムを使用したバス:
1-コンクリート底; 2 - スチールカソード; 3 - コンクリートカバー; 4 - ブライン供給パイプ; 5 - 塩素除去用パイプ。 6 - グラファイト陽極; 7 - 水素を除去するためのフィッティング。 8 - 電解液を排出するためのチューブ; 9 - 銅導体
カーネル
蒸着ダイアフラム槽の例は、タイプ S フッカー槽です。 2. この浴槽は、コンクリートの底部、スチール製のカソード、コンクリートのカバーの 3 つの主要部分で構成されています。 底は長方形のトラフの形をしており、グラファイトアノードの下端には鉛と電流を供給する銅棒が充填されています。 アノードはグラファイトプレートです。 カソードは、一連のフラット スチール メッシュ ポケットが内部に取り付けられたスチール フレームです。 ポケットの位置と幅は、カソードが槽の底に取り付けられたときに、ポケットがアノードの間に正確に配置されるようになっています。
塩水の供給と塩素の除去のために、浴槽のふたに開口部があります。 電解槽には断熱材があり、環境への熱伝達によるエネルギー損失を減らします。
水銀カソードとグラファイトアノードを備えた浴中の塩化ナトリウム溶液の電気分解。
ダイヤフラム付きのバスよりも、より濃縮された製品を受け取る機会を与えます。
NaCl 溶液に一定の電流を流すと、グラファイト アノードで C1 イオンの放電が発生し、続いて塩素ガスが放出されます。
2C1 - - 2位 Y С1 2
水銀カソードでは、大きな過電圧で水素発生が発生します。 鉄陰極の場合、中性溶液からの水素発生の可能性は 0.415 です。 V、水銀陰極では 1.7 - 1.85 です。 V.ナトリウムは、過剰な水銀に溶解するナトリウム アマルガム NaHg n の形成による大きな脱分極効果で水銀上に放出されます。 このため、水銀陰極でのナトリウム放電の電位は平衡電位、つまり 1.2 V よりも低く、平衡電位は 2.71 です。 V.したがって、次のプロセスが水銀カソードで行われます。
ナ + + eÞ ナ
ナ+ n H g= NaHg n
水素はほとんど放出されません。
ナトリウムアマルガムは特別な装置で分解します - 反応による水との分解器
NaHg n + H 2 0 = NaOH + 1/2H 2 + NHg
水銀カソードを備えた浴での電気分解は、平均して4.3〜4.4の電圧で進行します V.
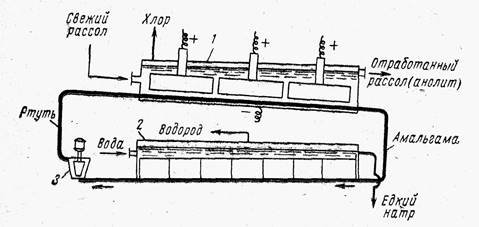
水銀カソードのバス、 回路図これを図に示します。 3は、電解槽と分解槽の2つの部分で構成されています。
 電解槽と分解槽は、構造的に分離してパイプラインで相互に連絡することも、1 つの共通のケーシング内に配置することもできます。
電解槽と分解槽は、構造的に分離してパイプラインで相互に連絡することも、1 つの共通のケーシング内に配置することもできます。 いずれにせよ、セルは長方形の断面の長い箱で、上部が蓋で閉じられており、その中にグラファイト陽極が固定されています。 米。 3.水銀カソードを備えたバスのスキーム:
1-電解槽; 2 - 分解者; 3 - ポンプ
カソード バスは、バスのわずかに傾斜した底に接続されており、水銀の薄い層がそれに沿って連続的に移動します。 したがって、お風呂の底は陰極です。 電解槽には、濃縮された (310-315 g/l)電気分解の過程で260-270の濃度まで食卓塩が枯渇する塩化ナトリウム溶液 グラム/リットル、を浴から取り出し、真空下で脱塩素し、圧縮空気を吹き込み、塩で飽和させ、不純物を取り除き (図には示されていません)、電気分解に戻します。 生成された塩素は、浴槽のふたから除去されます。
電気分解中に水銀がセルの底に沿って移動すると、ナトリウム アマルガムが得られます。これは水銀に溶解し、セルから分解器に除去されます。 デコンポーザーは、水平型と垂直型のさまざまなデザインにすることができます。 水平分解器は、蓋で閉じられた長方形のシュートです。 水が分解器に入り、結果として生じる生成物である水素とアルカリがそこから除去されます。 分解器の底はわずかに傾斜しているため、水銀は底に沿って移動し、分解器からエレベーターで除去されます さまざまな種類電解槽に移します。
水銀陰極浴は 広いエリア、水銀陰極の水平配置に関連付けられています。 垂直アマルガムディスクがカソードとして機能するバスがあります。 これらのバスはコンパクトですが、設計と操作が複雑です。
2 種類の浴の主な性能指標を比較すると、水銀陰極を使用した浴の電圧が高いため、エネルギー消費量がダイヤフラム浴よりも高いことがわかります。 また、水銀陰極槽は隔膜槽よりも操作が難しく、設置にかかる資本コストが高く、隔膜槽を設置している店舗よりも水銀槽を設置している店舗での作業条件が厳しい。
水銀浴で食塩を含まない濃縮液が得られる可能性は、水銀浴の本質的な利点です。 これに基づいて、純粋なアルカリが必要なすべての場合(ビスコース繊維の製造など)では、水銀陰極を備えた浴を優先する必要があります。 純粋な苛性アルカリの需要が高まっているため、水銀カソードを使用した浴での電気分解が広まっています。
電気分解によって得られた溶液の形のアルカリは、蒸発器で濃縮されます。 ダイヤフラム槽のアルカリには最大 130 ~ 140 が含まれています。 g/l NaOH と 180-170 g/l塩化ナトリウム。 食塩の溶解度は、溶液中の NaOH の濃度が高くなると減少します。 したがって、50% を含む灰汁 (769 g/l) NaOH、20°C での NaCl の溶解度は 13.9 g/l。その結果、ダイヤフラム付きの浴で得られた電解液の蒸発中に、溶液の濃縮とともに、塩化ナトリウムの結晶化が起こり、これが電気分解に戻されます。 実際には、蒸発および溶融後、92~94%のNaOH、2~3%のNaClを含有するアルカリが得られる。
結論。
したがって、水酸化ナトリウムは現在、塩化ナトリウム水溶液の電気分解によって製造されています。 この場合、2種類の電解槽が使用され、それぞれに長所と短所があります。 しかし、どちらの場合も、水酸化ナトリウムを得るプロセスには、人間と環境の両方にとって危険な物質であるガス状の副産物の生成が伴います. したがって、この生産では特別な安全対策を遵守する必要があります。
文学。
1. 化学技術全般。 エド。 I.P. ムクレノフ。 大学の化学技術専門の教科書。 M : 高校です。
2. Furmer I.E.、Zaitsev V.N. 化学技術全般。 - M .: 高校、1978 年。
(苛性ソーダ)は、吸湿性を有する顆粒または溶融塊の形をした白色の固体物質です。 溶解すると、熱を放出する傾向があります。 苛性ソーダ(NaOH式)は、組織、皮膚、その他の有機物に対して強い破壊作用があるため、「苛性アルカリ」または「苛性ナトリウム」と呼ばれ、 製造業-「コースティック」。 液体状態では、通常、沈殿物が形成される可能性のある着色または無色の液体。
苛性ソーダ:用途
苛性ソーダ (水酸化ナトリウム) は、家庭用だけでなく、さまざまな産業で使用されています。 これは最も一般的なアルカリです。
苛性ソーダは、次の分野で使用されています。
- 苛性ソーダは登録食品添加物 E524 で、アイスクリーム、チョコレート、各種飲料の製造、オリーブの軟化剤などに使用されています。
- 紙パルプ産業(段ボールの製造、 他の種類紙、木質繊維板、人工繊維など);
- 植物油から作られるバイオディーゼル燃料の生産のため。
- 化学産業(洗剤の製造、酸化物と酸の中和、アルミニウムの滴定、油の製造など);
- 軽工業(織物の漂白、絹の生産);
- 自動車生産(アルカリ電池の製造に使用);
- 食品産業(洗浄装置、食品加工および製造用)。
苛性ソーダ製造
水酸化ナトリウムを得る最も一般的な方法は、岩塩 (NaCL) の水溶液の電気分解によるものです。 化学反応には、水素と塩素の放出が伴います。
多くの場合、苛性ソーダは、ポリマーまたはアスベストのカソードを使用した電気分解 (膜および隔膜法) によって生成されますが、水銀カソードを使用した電気分解によって生成されることはほとんどありません。
最も便利な方法は、陰極が金属水銀である水銀製造法です。
水銀水素の高い過電圧係数の助けを借りて、カソードのナトリウムイオンが放出され、その結果、ナトリウムアマルガムが得られ、これが分解して お湯. その結果、不純物が含まれていないため、非常に純粋な NaOH が得られます。 しかし、金属水銀の使用は環境汚染を引き起こすため、この方法は非常に有害であると考えられています。
メンブレン法とダイヤフラム法は、より効率的で費用対効果が高いです。 これらは、世界中で最も頻繁に使用されているものです。

製品包装
苛性ソーダは種類によっては包装可能 違う方法. 固体状態では、スチールドラムに組み立てられます。 苛性ソーダの溶液は、特殊な自動車用コンテナや鉄道タンクに注がれます。

物質貯蔵
液体ソーダは、アルカリに耐性のある密閉容器に屋内で保管されます。 固体苛性ソーダは密閉された非加熱倉庫に包装された状態で保管されます。
交通機関
苛性ソーダは、輸送手段 (鉄道、道路、水路) によって輸送されます。 固体苛性ソーダの配送を行う場合、本製品は袋詰めし、液状のものは専用の鉄道タンクやコンテナで輸送します。 苛性ソーダを輸送するときは、熱と湿気を避ける必要があります。
製造日から苛性ソーダの保管保証期間 - 1年。

説明
世界では年間 5,800 万トン以上の苛性ソーダが採掘され、使用されています。 この物質には 比重 2.13、水にはよく溶けますが (0 度 - 43% の温度で)、ジクロロエタンには溶けません。 苛性ソーダは脱気液2号を作るのに使われ、さらに、この物質はエリアを脱気するために使われます。 アンモニアアルカリ溶液No. 2は、次の成分で構成されています。
- 水酸化ナトリウム (2%);
- アンモニア (20%);
- モノエタノールアミン (5%)。
このソリューションは、サリンなどの有毒物質で汚染された軍用機器、軍用車両、およびさまざまな武器のガス抜きに使用されます。
アンモニアおよびモノエタノールアミンは、脱気剤として、および組成物の凝固点を-40℃に下げるために使用されます。 このソリューションは、容量が100リットルと250リットルの鉄製のバレルに保管され、軍事ユニットや生産施設の場所に輸送されます。
濃縮溶液は、靴や生地を破壊するだけでなく、人の皮膚を腐食させる可能性があります.
予防措置
この物質を取り扱う際には、含まれる可能性のある危険性を忘れてはなりません。 苛性ソーダ (化学式 NaOH) は苛性で腐食性があり、第 2 危険クラスに属します。 それを扱うときは、必要なすべての予防措置に従ってください。 目や皮膚に触れると、重度の化学熱傷を引き起こす可能性があります。
苛性ナトリウムが粘膜面に付着した場合は、直ちに流水で患部を洗い流し、皮膚に付着した場合は酢酸溶液で拭き取ってください。
- 防沫ゴーグル(目の保護用);
- ゴム手袋(手を保護するため);
- ゴム引きスーツまたはビニールを含浸させたオーバーオール (胴体を保護するため)。
苛性ソーダの使用は多くの生産分野で行われており、日常生活でも行われていますが、このソーダとは何で、なぜそれほど有用なのですか?
苛性ソーダとは?
苛性ソーダは、最も有名で一般的な強アルカリの 1 つです。 化学式これはNaOHです。
上記のものに加えて、この物質には次の名前もあります:苛性、水酸化ナトリウム、苛性アルカリまたは苛性ソーダ。 水酸化物自体は鱗状の顆粒で表されます 白色においがないこと。 スケールのサイズは0.5 mmに達することがあります。
苛性ソーダの有用な特性

この物質は吸湿性に優れており、液体によく溶けます。 溶解中、熱が放出され始めます。 アルカリは、あらゆる種類の輸送に容易に耐えます。 集約状態によって異なります。 タンクは液体で使用され、バッグは固体で使用されます。
Caustic は、医療、化学、冶金、自動車、食品、光、ガス、石油など、多くの業界で一度に安定した地位を築いてきました。
この物質は多くの産業分野で受け入れられていますが、それにもかかわらず、 ネガティブな性質. 欠点は次のとおりです。
- アルカリは腐食性であり、保護具を使用する必要があります。
- 腐食剤は浴槽のエナメル質を腐食させる可能性があるため、注意して作業を行う必要があります。
それでも、ソーダには多くの肯定的な側面があります。 
- 脂肪および有機堆積物の100パーセントの腐食;
- 下水道が洗い流された後でも、灰汁は機能します。
- パイプの粗さを簡単に滑らかにし、堆積を遅くします。
- 月に一度だけ使用するだけで十分です。
- 低価格と可用性。
- この物質には強力な破壊特性があり、亜鉛とアルミニウムを腐食する可能性があります。 ソーダは産業消毒の過程で使用されます。 苛性ソーダは爆発性であり、その可燃性は危険性が高いと分類されています。
苛性ソーダのその他の特性
- アセトンとエーテルには完全に溶けません。
- グリセリン、エタノール、メタノールのアルコール溶液への溶解度が高い。
- この物質は不燃性で、融点は摂氏318度です。
- 摂氏1390度の温度で沸騰します。
- 苛性アルカリの最も危険な特性は、金属アルミニウム、鉛、亜鉛、スズと接触したときの鋭く激しい反応にあります。
- それは強力な塩基であり、爆発性の可燃性ガスを形成する可能性があります。
- 苛性ソーダがアンモニアと接触すると、火災の危険が生じます。
- 溶融状態では、ガラスや磁器を破壊する可能性があります。
家庭での日常生活への応用

安全性
水酸化ナトリウムは、ほとんどすべてのコーティングを容易に腐食させる強力なアルカリ溶液です。 ソーダを使用するときは、健康を維持するためのルールに従う必要があります。 アルカリは取り扱いを粗末にすると皮膚に付着して腐食し、湿疹や潰瘍の原因となります。 目や口の粘膜に入った炭酸飲料も大変危険です。 物質は液体を完全に吸収し、熱を放出し始めます。この場合、やけどは避けられなくなります。 これが起こらないようにするには、コースティックを処理する際のルールに従うようにする必要があります。
使用説明書

 どれでも 危険な薬必然的に慎重かつ慎重な取り扱いが必要であり、苛性ソーダもその範疇に入る。 苛性ソーダの混合物を購入するときは、真剣かつ重要であり、すべてを完全に研究する必要があります 必要な推奨事項従う必要があります。 そうすれば、腐食剤のような危険な物質でさえ家事を助け、生命と健康に害を及ぼすことはありません。
どれでも 危険な薬必然的に慎重かつ慎重な取り扱いが必要であり、苛性ソーダもその範疇に入る。 苛性ソーダの混合物を購入するときは、真剣かつ重要であり、すべてを完全に研究する必要があります 必要な推奨事項従う必要があります。 そうすれば、腐食剤のような危険な物質でさえ家事を助け、生命と健康に害を及ぼすことはありません。
プロポーション
鉄鋼を煮沸する際、樹脂の付着物を除去するために、 古い塗料車のフレームには、1 リットルあたり 50 ~ 100 グラム以上の濃度の苛性混合物が必要です。 アルミニウムを脱脂するには、1リットルあたり25~30グラムの焼成水酸化ナトリウム、1リットルあたり25~30グラムのリン酸三ナトリウム、および1リットルあたり10~15グラムの液体ガラスの溶液が必要です。
同時に、温度は常に摂氏80度からキープされます。
広範な家庭用

すべての不安にもかかわらず、苛性アルカリは日常生活のあらゆる場所で人々によって使用されています。 パイプや調理器具の洗浄、石鹸の製造、時にはガーデニングの溶剤として使用されます。
水酸化ナトリウムの貯蔵寿命は、メーカーによる発売日から 1 年です。 有効期限が過ぎると、ソリューションはその特性を部分的に失います。つまり、それ以上使用しても、望ましい結果が得られなくなります。 苛性アルカリは、できれば密閉容器に入れて、暗くて涼しい場所に保管してください。
スケールやグリースの除去
食器が物質によって損傷を受けるため、この方法でアルミニウムまたはテフロン製品を洗浄しないでください。 皿の水あかを取り除くには、ソーダを好きな粉末と混ぜ、水で薄めますが、液体にならないようにし、汚染された場所に30分間適用する必要があります. その後、きれいに洗い流すとスケールが落ちます。
下水道清掃用途

苛性ソーダは、家庭だけでなく企業でもよく使用されています。 いくつかのニーズを満たすために さまざまなソリューション. 最もよくある質問は、適用時に高品質の結果を得るために、苛性ソーダをどのように希釈する必要があるかということです。
下水道は苛性アルカリで洗浄されます。これは、溶液がパイプ上の脂肪やタンパク質の堆積物を効果的かつ簡単に腐食できるためです。 苛性アルカリでパイプの表面をきれいにするには、ソーダ自体を含む薬液を購入して、排水口に注ぐだけです。
下水道の清掃に使用できるその他のオプション:
- 重曹とお酢は別の使い方もできます。 125グラムの酢をパイプに注ぎ、苛性を埋める必要があります。 しばらくすると、激しい反応が始まり、しばらくの間、かなり大量の泡が放出されます。 このため、排水管をコルクで数時間しっかりと密閉することをお勧めします。 時間が経過したら、沸騰したお湯を排水口に注ぎます。 この方法は、パイプの表面から堆積物を除去するのに効果的です。
- 他にもあります 効果的な方法パイプ洗浄。 7 リットルの水に 4 キログラムの苛性ソーダを混ぜる必要があります。 次に、すべてを完全に混合し、得られた混合物を排水口に注ぎます。
- 次のようにして、パイプの詰まりを取り除くこともできます。大さじ3杯の物質を排水口に注ぎ、その上に250グラムの熱湯を注ぎます。 次に、最初の方法と同様に、2 ~ 3 時間待ちます。 反応終了後、ドレンを多量の水で洗い流してください。
石鹸作り
お店で売っている手作り石鹸は、結構な値段がします。
石鹸製品は自分の手で作ることができます。これには次のものが必要です。 
- 水酸化ナトリウム;
- 油;
- 水はきれいです。
- アロマを実現するオイル。
石鹸作りのプロセス自体はとてもシンプルですが、すべての比率を観察するには非常に正確で正確さが必要です. ソーダは慎重に水で希釈して混合する必要があります。 次に、ウォーターバスで油を加熱し、アルカリ溶液に注ぎます。 その後、粘り気のある粘り気のある混合物が得られます。 2~3滴加えます エッセンシャルオイル香りを生み出すもの。 得られた結果は準備された型に分解され、24時間後にはすでに自分で作った石鹸を使用できるようになります.
洗剤
現在、絶対にすべての最新の粉末洗剤の組成には、常に苛性ソーダが含まれています。 これは、洗浄中に苛性アルカリを別々に使用できることを意味します。 の 洗濯機大さじ3杯から5杯のソーダで眠りにつく必要がありますが、その量は衣服の汚れ具合によって異なります。 洗濯は摂氏50度から100度の温度で行う必要があります。 また、重曹は手洗いにも使えます。 これにより、粉が節約され、汚れが簡単に取り除かれます。 10リットルの水に大さじ3杯の苛性ソーダを加えます。 浸漬プロセス中、洗濯物をアルカリ溶液に2時間浸すことをお勧めします。 
苛性ソーダも床の掃除に役立ちます。 まず、解決策を作る必要があります: 5 リットルあたり大さじ 3 杯 温水. この方法では、床はアルカリ溶液自体で洗浄されます。 次に、苛性溶液の後、床を真水で洗い、注意深く拭きます。 このような物質を使用すると、汚れを取り除くだけでなく、部屋の床を効率的かつ効果的に消毒することが簡単になります。
したがって、苛性アルカリは家庭での日常生活でよく使用されます。 この物質は非常に大きな危険を伴いますが、その合理的な使用は非常に多くの有用なことを行い、かなりの数の日常の困難や問題を解決するのに役立ちます.
プラスチック下水道の清掃
自宅で、簡単に洗剤を作ることができます プラスチックパイプ、手元にあるものを使って、ソーダと洗濯用洗剤。 ソーダはより効果的で、苛性アルカリと酢の溶液を混ぜると役立ちます。
- まず、大さじ 3 ~ 4 杯の苛性ソーダを溝に注ぎ、その上から酢を注ぎ、コルクで排水管をしっかりと閉じます。
- シャワーから噴霧器を取り外し、シャワーホースを穴に挿入します。
- 残りの空きスペースをタオルまたはぼろきれで閉じ、シャワーを最大の圧力でオンにし、排水口を勢いよくすすぎます。
これで目的の結果が得られない場合は、閉塞を手動で解消する別の方法があります。

汚水溜めを掃除するには
セスプールを苛性アルカリで掃除することは、非常に効果的かつ効率的です。 しかし、結果を達成するには、必要なすべての使用規則に従う必要があります。
たとえば、化学的に暴力的な物質は戦うだけでなく、 不快な臭い廃棄物から利用できますが、土壌にも悪影響を及ぼします。
これを理解した上で、コースティックを特に乱用すべきではありません。
この場合に水酸化ナトリウムを試した一部の人々は、このアルカリが地球だけでなく人間や動物にも悪影響を与える可能性があると報告しています.
最も重要であり、 重要なルール苛性ソーダでセスプールを清掃する際の安全性は、ピットを完全に密閉することです。
そうでなければ、腐敗槽の境界を越えて感染や病気を広める昆虫の出現の脅威があります。
ガスが大量に発生すると爆発するため、ガスの蓄積を決して忘れてはなりません。つまり、スムーズに機能する換気システムを作成する必要があります。
すべての手順の前に、水酸化ナトリウムの溶液を水で希釈する必要があります。
一連のアクションに進むことができます。
これには、次のものが必要です。 
- 10リットルのプラスチックバケツ;
- 小さなシャベルまたはスクープ;
- ゴム手袋;
- マスクとゴーグル。
苛性ソーダは粉末の状態でピットに注ぐのではなく、すでに水に溶かして注ぎます。
まず、スクープまたはへらを使用して、2〜4キログラムの水をバケツに注ぎます。その量は、ピット自体の容積によって異なります。
次に、粉末に7〜8リットルの水を注ぎ、よく混ぜます。 溶解すると熱が放出され始め、少し後に摂氏60度に達します。
時間の経過とともに、ソーダが溶解した後、結果として生じる塊が下水ピットに注がれますが、常に可能な限りすべての保護具(メガネと手袋)を着用しています。
混合物の積極的な作用は4分で、サイクル数に応じて2つあるはずです。
安全装備を忘れないでください。 アルカリが皮膚に付着すると、化学火傷が現れ、皮膚と溶液との接触が長くなり、潰瘍または湿疹が現れることがあります。 それにもかかわらず、製品が皮膚に付着した場合は、すぐに大量の水の流れで傷を洗い、次に2%のホウ酸溶液で洗い流してください。
目に入った場合はすぐに洗い流してください 温水 5分以内。
皮膚刺激の兆候がある場合は、医師に相談してください。
食品産業における苛性ソーダの使用

食品業界では、苛性アルカリは栄養補助食品、E-524 レギュレーターとして知られています。 キャラメルやアイスクリームのほか、レモネードやココアなどの製品にも広く使用されています。 苛性ソーダは、ベーカリー製品やマフィンを焼くプロセスにも関与して、ふっくらとした一貫性を実現します。製品を焼く前に苛性アルカリの溶液で処理すると、パンはサクサクした金色の皮になります. ソーダは、さまざまな食品の最も繊細で柔らかい一貫性を得るために適切かつ合理的に使用されます. たとえば、魚を水酸化ナトリウムに浸して特別なゼリー状の塊を作り、これをルテフィスク皿の準備に使用します。 そのような事実があります:オリーブを柔らかくし、それらを着色する 暗色苛性ソーダも使用。
どこで買えますか?
現在、ほとんどすべての便利な場所で水酸化ナトリウムを購入できます。 苛性ソーダは、そのような製品の専門店の小売店で購入することができます。 さらに、苛性アルカリはバルクで販売されており、工業センターにとって有益です。
水酸化ナトリウムも他のアルカリも、「苛性アルカリ」という名前は、皮膚、紙、ガラスを腐食させ、重度の火傷を引き起こす性質によるものです。 17世紀まではアルカリ(fr. アルカリ) は、炭酸ナトリウムおよび炭酸カリウムとも呼ばれます。 フランスの科学者 A.L. デュアメル デュ モンソーでは、これらの物質が最初に区別されました。 . 現在、ソーダは一般に炭酸ナトリウム塩と呼ばれています。 英語とフランス語では、ナトリウムという言葉はナトリウム、カリウム - カリウムを意味します。
物理的特性
水酸化ナトリウム
溶液の熱力学
Δ H0無限希釈水溶液の溶解 -44.45 kJ / mol。
12.3 - 61.8 ° C の水溶液から、一水和物が結晶化し (菱形同義)、融点 65.1 ° C; 密度 1.829 g/cm³; ΔH 0 arr-734.96 kJ / mol)、-28から-24°Сの範囲 - 七水和物、-24から-17.7°С - 五水和物、-17.7から-5.4°С - 四水和物(α修飾)、-5.4から12.3℃まで。 メタノールへの溶解度 23.6 g/l (t=28°C)、エタノールへの溶解度 14.7 g/l (t=28°C)。 NaOH 3.5H 2 O(融点15.5℃);
化学的特性
(一般に、このような反応は単純なイオン方程式で表すことができ、反応は熱の放出とともに進行します(発熱反応): OH - + H 3 O + → 2H 2 O。)
- 塩基性と酸性の両方の特性を持ち、溶融した場合の固体と同様に、アルカリと反応する能力を持つ両性酸化物:
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O
およびソリューション付き:
ZnO + 2NaOH (溶液) + H 2 O → Na 2 (溶液)+H2
(得られた陰イオンはテトラヒドロキソシン酸イオンと呼ばれ、溶液から分離できる塩はテトラヒドロキソシン酸ナトリウムです。水酸化ナトリウムも他の両性酸化物と同様の反応を起こします。)
- 酸性酸化物で - 塩の形成で; このプロパティは、酸性ガス (例: CO 2 、SO 2 および H 2 S) からの産業排出物を浄化するために使用されます。
2Na + + 2OH - + Cu 2+ + SO 4 2- → Cu(OH) 2 ↓+ Na 2 SO 4
水酸化ナトリウムは、金属水酸化物を沈殿させるために使用されます。 例えば、水溶液中の硫酸アルミニウムに水酸化ナトリウムを作用させることにより、ゲル状の水酸化アルミニウムが得られる。 特に、細かい懸濁液から水を浄化するために使用されます。
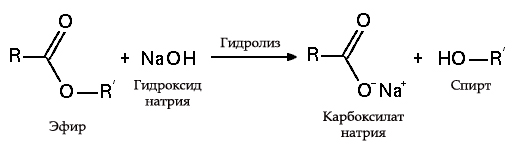
エステル加水分解
- 脂肪(ケン化)では、結果として生じる酸とアルカリが石鹸とグリセリンを形成するため、この反応は不可逆的です。 続いて、グリセリンは、真空蒸発および得られた生成物の追加の蒸留精製によって石鹸液から抽出される。 この石けんの作り方は、7 世紀から中東で知られていました。
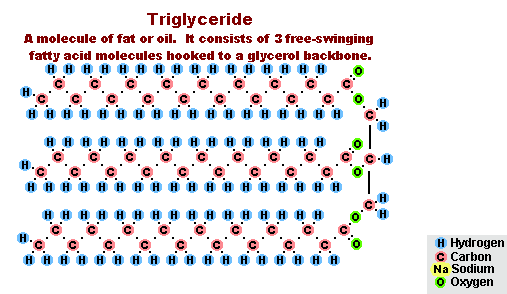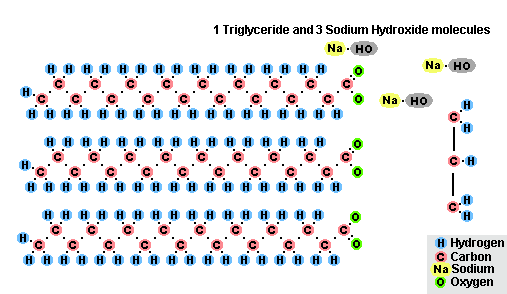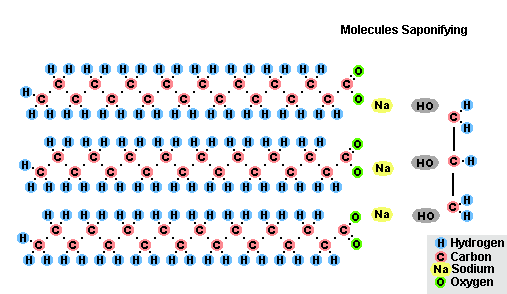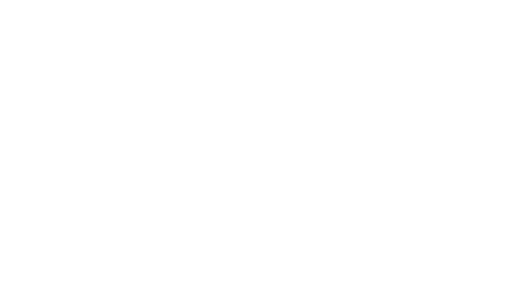
脂肪のケン化のプロセス
脂肪と水酸化ナトリウムとの相互作用の結果として、固体石鹸が得られ(固形石鹸の製造に使用されます)、水酸化カリウムとは、脂肪の組成に応じて固体または液体石鹸が得られます.
HO-CH 2 -CH 2 OH + 2NaOH → NaO-CH 2 -CH 2 -ONa + 2H 2 O
2NaCl + 2H 2 O \u003d H 2 + Cl 2 + 2NaOH、現在、苛性アルカリと塩素は、3 つの電気化学的方法で製造されています。 そのうちの 2 つは、固体アスベストまたはポリマー陰極による電気分解 (ダイヤフラムおよび膜製造法) であり、3 つ目は、液体陰極による電気分解 (水銀製造法) です。 多くの電気化学的製造方法の中で、最も簡単で便利な方法は水銀カソードを使用した電気分解ですが、この方法は重大な害をもたらします。 環境金属水銀の蒸発と漏れの結果として。 膜の製造方法は、最も効率的で、エネルギー消費が少なく、最も環境に優しい方法ですが、特に最も気まぐれで、より純度の高い原材料を必要とします。
液体水銀陰極による電気分解で得られる苛性アルカリは、隔膜法で得られるアルカリよりもはるかにクリーンです。 一部の業界では、これは重要です。 そのため、人工繊維の製造では、液体水銀カソードを使用した電気分解によって得られた苛性アルカリのみを使用できます。 世界の慣例では、塩素と苛性アルカリを得るために 3 つの方法すべてが使用されており、膜電解の割合が増加する傾向が明らかです。 ロシアでは、生産される全苛性アルカリの約 35% が水銀陰極による電気分解によって、65% が固体陰極による電気分解 (隔膜法および膜法) によって生産されます。
製造工程の効率は、苛性ソーダの収率だけでなく、電気分解で得られる塩素と水素の収率で計算され、出口での塩素と水酸化ナトリウムの比率は 100/110 であり、反応は次の比率:
1.8 NaCl + 0.5 H 2 O + 2.8 MJ = 1.00 Cl 2 + 1.10 NaOH + 0.03 H 2、基本指標 さまざまな方法生産は表に示されています:
| NaOH 1トンあたりの指数 | 水銀法 | ダイヤフラム方式 | 膜法 |
|---|---|---|---|
| 塩素出力 % | 97 | 96 | 98,5 |
| 電気(kWh) | 3 150 | 3 260 | 2 520 |
| 水酸化ナトリウム濃度 | 50 | 12 | 35 |
| 塩素の純度 | 99,2 | 98 | 99,3 |
| 水素純度 | 99,9 | 99,9 | 99,9 |
| 塩素中のO 2の質量分率、% | 0,1 | 1-2 | 0,3 |
| NaOH中のCl - の質量分率、% | 0,003 | 1-1,2 | 0,005 |
固体陰極による電気分解の技術スキーム
ダイヤフラム方式 - 固体カソードを備えたセルの空洞は、多孔質の隔壁 (ダイアフラム) によって、セルのカソードとアノードがそれぞれ配置されているカソードとアノードの空間に分割されています。 したがって、このような電解槽は隔膜電解槽と呼ばれることが多く、製造方法は隔膜電解槽です。 飽和陽極液の流れは、隔膜セルの陽極空間に連続的に入ります。 電気化学プロセスの結果として、塩素は岩塩の分解によりアノードで放出され、水素は水の分解によりカソードで放出されます。 塩素と水素は、混合せずに別々に電解槽から除去されます。
2Cl - - 2 e\u003d Cl 2 0、H 2 O - 2 e− 1/2 O 2 \u003d H 2。
この場合、カソード付近のゾーンには水酸化ナトリウムが豊富に含まれています。 分解されていない陽極液と水酸化ナトリウムを含む、電解液と呼ばれる陰極ゾーンからの溶液は、電解槽から連続的に除去されます。 次の段階で、電解液を蒸発させ、その中の NaOH の含有量を基準に従って 42 ~ 50% に調整します。 水酸化ナトリウムの沈殿物の濃度の増加に伴う岩塩と硫酸ナトリウム。 苛性溶液は沈殿物からデカントされ、最終製品として倉庫または蒸発段階に移されて固体製品が得られ、その後、溶融、フレーク化、または造粒が行われます。 結晶性岩塩(逆塩)は電気分解に戻され、そこからいわゆる逆塩水が調製されます。 そこから、溶液中の硫酸塩の蓄積を避けるために、戻り塩水を調製する前に硫酸塩が抽出されます。 陽極液の損失は、塩層の地下浸出または固体岩塩の溶解によって得られる新鮮なブラインの追加によって補償されます。 逆塩水と混合する前に、新鮮な塩水から機械的懸濁液とカルシウムおよびマグネシウムイオンの大部分を取り除きます。 得られた塩素は水蒸気から分離され、圧縮され、塩素含有製品の製造または液化に供給されます。
膜法 - ダイヤフラムに似ていますが、陽極と陰極の空間は陽イオン交換膜で隔てられています。 膜電解は、最も純粋な苛性アルカリを提供します。
技術系電解。主な技術段階は電気分解であり、主な装置は電気分解装置、分解装置、水銀ポンプで構成され、通信で相互接続された電解槽です。 電解槽では、水銀ポンプの作用により、水銀が循環し、電解槽と分解槽を通過します。 電解槽のカソードは水銀の流れです。 アノード - グラファイトまたは低摩耗。 水銀とともに、陽極液の流れ (岩塩溶液) が連続的に電解槽を流れます。 岩塩の電気化学的分解の結果として、Cl イオンがアノードで形成され、塩素が放出されます。
2Cl - - 2 e= Cl 2 0 、
これは電解槽から取り除かれ、水銀カソード上に形成されます 弱い解水銀中のナトリウム、いわゆるアマルガム:
Na + + e \u003d Na 0 nNa + + nHg - = Na + Hgアマルガムは、電解槽から分解槽に連続的に流れます。 また、分解器には常に浄水された水が供給されています。 その中で、自発的な電気化学的プロセスの結果として、ナトリウムアマルガムは、水銀、苛性溶液、および水素の形成を伴う水によってほぼ完全に分解されます。
Na + Hg + H 2 0 = NaOH + 1/2H 2 + Hgこのようにして得られた市販品の苛性溶液には、ビスコースの製造に有害な岩塩不純物が含まれていません。 水銀はナトリウムアマルガムからほぼ完全に解放され、電解槽に戻されます。 精製のために水素を除去する。 電解槽を出る陽極液は、新鮮な岩塩で飽和され、それとともに導入された不純物は、陽極および構造材料から洗い流され、そこから除去され、電気分解に戻されます。 再飽和の前に、2 段階または 3 段階のプロセスによって陽極液から塩素が抽出されます。
得るための実験方法
水酸化ナトリウムは実験室で生成されます 化学的手段による実際的な意味よりも歴史的な意味を持っています。
ライム法 水酸化ナトリウムの生成は、約80°Cの温度でのソーダ溶液と石灰乳との相互作用にあります。 このプロセスは苛性化と呼ばれます。 それは反応によって記述されます:
Na 2 CO 3 + Ca (OH) 2 \u003d 2NaOH + CaCO 3反応の結果、水酸化ナトリウムの溶液と炭酸カルシウムの沈殿物が形成される。 炭酸カルシウムを溶液から分離し、蒸発させて約92%のNaOHを含む溶融生成物を得る。 溶融した NaOH を鉄製のドラム缶に注ぎ、そこで凝固させます。
フェライトウェイ 次の 2 つの反応によって記述されます。
Na 2 CO 3 + Fe 2 0 3 = Na 2 0 Fe 2 0 3 + CO 2 (1) Na 2 0 Fe 2 0 3 -f H 2 0 \u003d 2 NaOH + Fe 2 O 3 (2)(1) - ソーダ灰と酸化鉄を 1100 ~ 1200°C の温度で焼結するプロセス。 この場合、ナトリウム スペック フェライトが形成され、二酸化炭素が放出されます。 次に、ケークは反応(2)に従って水で処理(浸出)される。 水酸化ナトリウムの溶液とFe 2 O 3 の沈殿物が得られ、それを溶液から分離した後、プロセスに戻す。 この溶液には、約 400 g/l の NaOH が含まれています。 それを蒸発させて、約92%のNaOHを含有する生成物を得る。
水酸化ナトリウムを製造するための化学的方法には、大量の燃料が消費される、得られる苛性ソーダが不純物で汚染される、および装置のメンテナンスが面倒であるという重大な欠点があります。 現在、これらの方法は、電気化学的製造方法にほぼ完全に取って代わられています。
苛性ソーダ市場
世界の苛性ソーダ生産量、2005 年| メーカー | 生産量、百万トン | 世界生産シェア |
|---|---|---|
| ダウ | 6.363 | 11.1 |
| オクシデンタル ケミカル カンパニー | 2.552 | 4.4 |
| 台湾プラスチックス | 2.016 | 3.5 |
| PPG | 1.684 | 2.9 |
| バイエル | 1.507 | 2.6 |
| アクゾ・ノーベル | 1.157 | 2.0 |
| 東ソー | 1.110 | 1.9 |
| アルケマ | 1.049 | 1.8 |
| オリン | 0.970 | 1.7 |
| ロシア | 1.290 | 2.24 |
| 中国 | 9.138 | 15.88 |
| 他の | 27.559 | 47,87 |
| 合計: | 57,541 | 100 |
TR - 固体水銀(フレーク状);
TD - 固体ダイアフラム (溶融);
RR - 水銀溶液;
РХ - 化学溶液;
RD - ダイヤフラム ソリューション。
| 指標名 | TR OKP 21 3211 0400 | TD OKP 21 3212 0200 | RR OKP 21 3211 0100 | РХ 1 グレード OKP 21 3221 0530 | РХ 2 グレード OKP 21 3221 0540 | RD 最高級 OKP 21 3212 0320 | RD 1年生 OKP 21 3212 0330 |
|---|---|---|---|---|---|---|---|
| 外観 | 白色のスケーリングされた塊。 弱着色可 | 溶けた白い塊。 弱着色可 | 無色透明の液体 | 無色または有色の液体。 結晶化した沈殿が許容される | 無色または有色の液体。 結晶化した沈殿が許容される | 無色または有色の液体。 結晶化した沈殿が許容される | |
| 水酸化ナトリウムの質量分率、%、以上 | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
| 商号 | 2005年 千トン | 2006年 千トン | 2005年シェア% | 2006年シェア% |
|---|---|---|---|---|
| JSC「カウスティック」、スターリタマック | 239 | 249 | 20 | 20 |
| JSC「カウスティック」、ヴォルゴグラード | 210 | 216 | 18 | 18 |
| JSC「サヤンスクヒンプラスト」 | 129 | 111 | 11 | 9 |
| ウソリーキンプロム LLC | 84 | 99 | 7 | 8 |
| OAO シブル・ネフテキム | 87 | 92 | 7 | 8 |
| OJSC「キンプロム」、チェボクサル | 82 | 92 | 7 | 8 |
| VOAO「キンプロム」、ヴォルゴグラード | 87 | 90 | 7 | 7 |
| ZAO イリムキンプロム | 70 | 84 | 6 | 7 |
| JSC「KChKhK」 | 81 | 79 | 7 | 6 |
| NAK「アゾット」 | 73 | 61 | 6 | 5 |
| OAO キンプロム、ケメロヴォ | 42 | 44 | 4 | 4 |
| 合計: | 1184 | 1217 | 100 | 100 |
| 商号 | 2005トン | 2006トン | 2005年シェア% | 2006年シェア% |
|---|---|---|---|---|
| JSC「カウスティック」、ヴォルゴグラード | 67504 | 63510 | 62 | 60 |
| JSC「カウスティック」、スターリタマック | 34105 | 34761 | 31 | 33 |
| OAO シブル・ネフテキム | 1279 | 833 | 1 | 1 |
| VOAO「キンプロム」、ヴォルゴグラード | 5768 | 7115 | 5 | 7 |
| 合計: | 108565 | 106219 | 100 | 100 |