Caracteristicile structurii atomilor nemetalici starea de oxidare. Planul de lecție. Poziția nemetalelor în PS lui D. I. Mendeleev. Caracteristici ale structurii atomice a elementelor nemetalice - Lecție
Zimonina Lyudmila Pavlovna
Subiectul lecției " Caracteristici generale nemetale" Obiectivele lecției:- Luați în considerare poziția nemetalelor în PS lui D.I Mendeleev și caracteristicile structurii lor electronice. Revedeți conceptele de electronegativitate (EO) și alotropie.
Progresul lecției.
eu Moment organizatoric Introducere în subiect. Deși există mult mai puține nemetale decât metale, este dedicat mult mai mult timp studierii chimiei lor decât metalele. Planul de lecție.- Poziția nemetalelor în PS lui D.I. Mendeleev. Caracteristicile structurii atomice a elementelor nemetalice. Caracteristicile substanțelor simple - nemetale. alotropie.
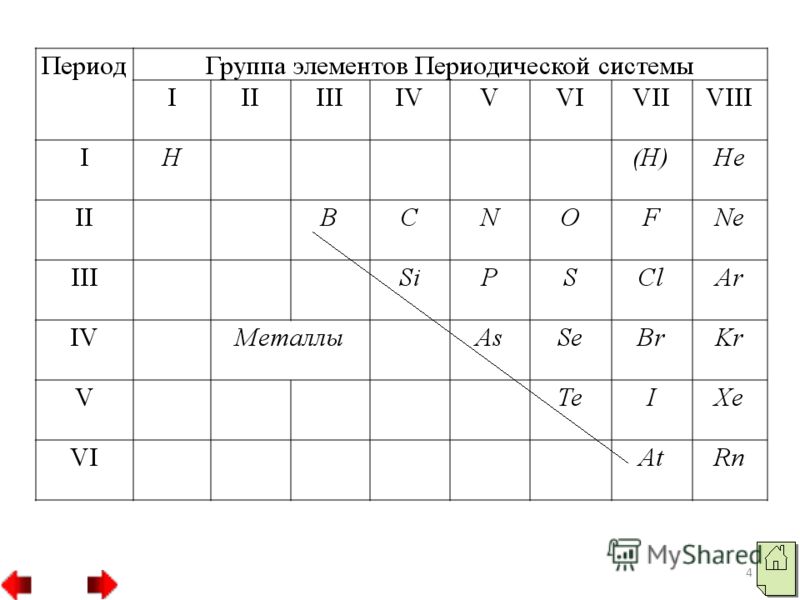
- Poziția nemetalelor în PS lui D.I. Mendeleev.
- Caracteristicile structurii atomice a elementelor nemetalice.
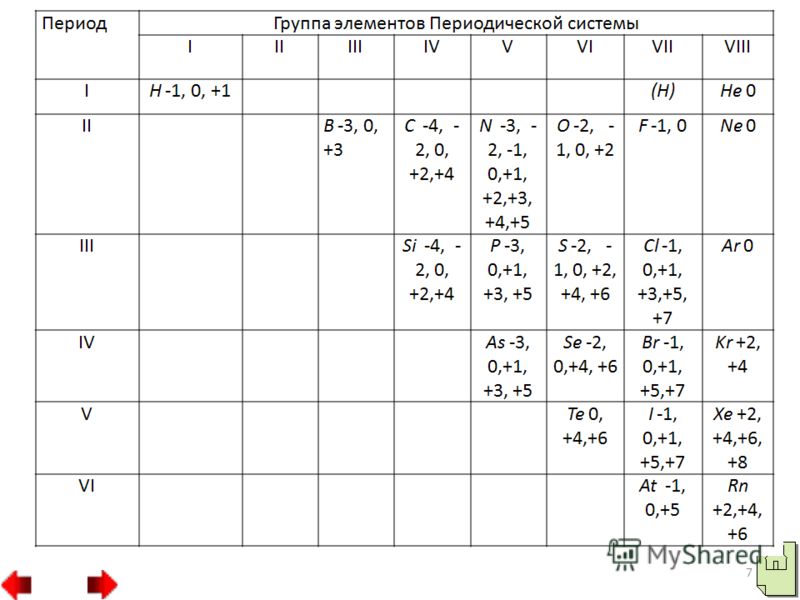
- Raza atomică mică (în comparație cu razele atomilor de metal din aceeași perioadă). Număr mai mare electroni la nivelul extern (4-8), cu excepția lui H, He, B. Numai nivelul energetic extern este umplut cu electroni. Elementele nemetalice se caracterizează prin valori ridicate de electronegativitate.
- Caracteristicile substanțelor simple-nemetale.
- Nemetale (substanțe simple) se caracterizează prin toate cele 3 stări de agregare în condiții normale (comparați - toate metalele, cu excepția mercurului, sunt substanțe solide în condiții normale).
- Solide: diverse modificări de sulf, iod cristalin, grafit, fosfor, cărbune activ, siliciu cristalin sau amorf, bor.
- Nemetalele se caracterizează printr-o varietate de culori: alb - fosfor, negru - fosfor, grafit, roșu - fosfor, brom, galben - sulf, violet - iod, incolor - oxigen, azot, hidrogen. (Aproape toate metalele sunt de culoare alb-argintiu.) Puncte de topire: de la 3800 0 C (grafit) la -210 0 C (azot). Pentru comparație, metale: de la 3380 0 C (tungsten) la -38,9 0 C (mercur). Unele nemetale sunt conductoare de electricitate (grafit, siliciu) și au un luciu metalic (iod, grafit, siliciu). Aceste caracteristici seamănă cu metalele, dar toate sunt substanțe fragile.
- alotropie.
- Diferite tipuri rețele cristaline (fosfor alb P 4 - molecular, fosfor roșu P - atomic). Structura diferită a rețelei cristaline (diamant – tetraedric, grafit – stratificat). Compoziție diferită a moleculelor de modificări alotropice (O 2 și O 3).
| Oxigen | ||
| Compoziția moleculei | ||
| Proprietăți fizice | Gaz, incolor, insipid și inodor, slab solubil în apă, albastru deschis în stare lichidă, albastru în stare solidă. Punct de topire -218,7 0 C Punct de fierbere -183 0 C | Gaz albastru deschis, lichid albastru închis, violet închis în stare solidă, miros puternic, de 10 ori mai bun decât oxigenul, solubil în apă. Punct de topire -193 0 C Punct de fierbere -112 0 C |
| Proprietăți chimice | Agent oxidant puternic 2Cu + O 2 = 2CuO 2PbS + 3O2 = 2PbO + 2SO2 | Un agent oxidant și mai puternic, deoarece are o moleculă instabilă 3PbS + 4O3 = 3PbS04 2Ag + O 3 = Ag 2 O + O 2 2KI + O 3 + H 2 O = I 2 + 2KOH + O 2 |
- Proprietățile chimice ale nemetalelor
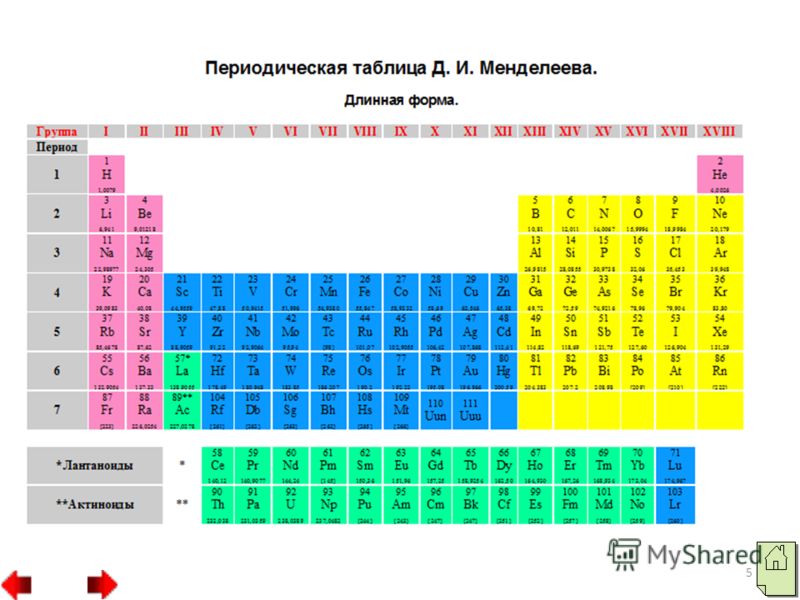
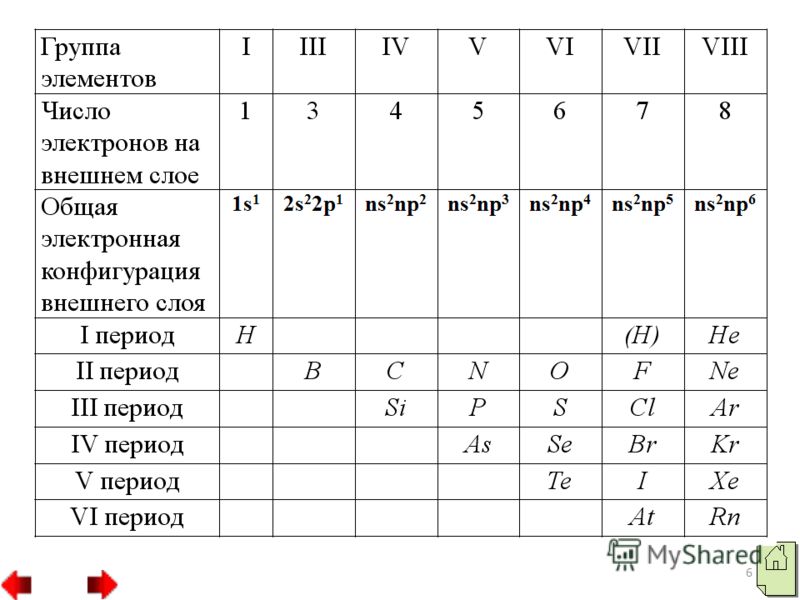
2 Nemetalele sunt elemente chimice ai căror atomi acceptă cu ușurință electroni pentru a finaliza un nivel exterior de energie, formând astfel ioni încărcați negativ. Elementele nemetalice sunt situate la sfârșitul perioadelor și au o configurație electronică a stratului exterior apropiată sau egală cu cea a celui mai apropiat gaz nobil. Aproape toate nemetalele au raze relativ mici și se caracterizează prin valori ridicate de electronegativitate și proprietăți oxidante.
3 Dintre nemetale, două elemente hidrogen și heliu aparțin familiei s, toate celelalte aparțin familiei p. Atomii nemetalici au un număr diferit de electroni pe stratul lor exterior de electroni: un atom de hidrogen are un electron (1s"), un atom de heliu are doi electroni și un atom de bor are trei electroni. Cu toate acestea, atomii majorității nemetalelor, spre deosebire de metal atomii, au pe stratul lor exterior de electroni au un număr mare de electroni de la 4 la 8. Toate substanțele nemetalice sunt formate din atomi legați unul de celălalt prin covalent legătură nepolară. Ele pot avea o structură moleculară, cum ar fi moleculele de hidrogen, oxigen, azot etc., sau o structură atomică, cum ar fi cristalele de diamant sau bor.

4
5
6
7
8 Rolul nemetalelor și al compușilor lor în natură este foarte mare. Nemetalele reprezintă mai mult de 84% din masa solului, 98,5% din masa plantelor și 97,6% din masa corpului uman. Șase nemetale carbon, hidrogen, oxigen, azot, fosfor și sulf sunt elemente organogenice, deoarece fac parte din moleculele de proteine, grăsimi, carbohidrați și acizi nucleici. Aerul pe care îl respirăm este un amestec de substanțe simple și complexe formate nemetale(oxigen, azot, dioxid de carbon).

9

10 Substanțele nemetalice cu structură moleculară pot fi în stare gazoasă, lichidă sau solidă. Toate, datorită forțelor intermoleculare slabe, au puncte de fierbere și de topire scăzute. Substanțele nemetalice cu structură atomică se găsesc numai în solide. starea de agregare, atomii lor sunt legați între ei prin legături covalente puternice și formează macromolecule, de exemplu, C n, S n, Si n. De obicei, au duritate mare și puncte de topire și fierbere ridicate. Multe nemetale sunt capabile să formeze modificări alotropice: O 2, O 3. Toate nemetalele conduc căldura prost și curent electric. Cristalele nemetalice sunt neductile și fragile. Majoritatea nemetalelor nu au un luciu metalic.

11


13

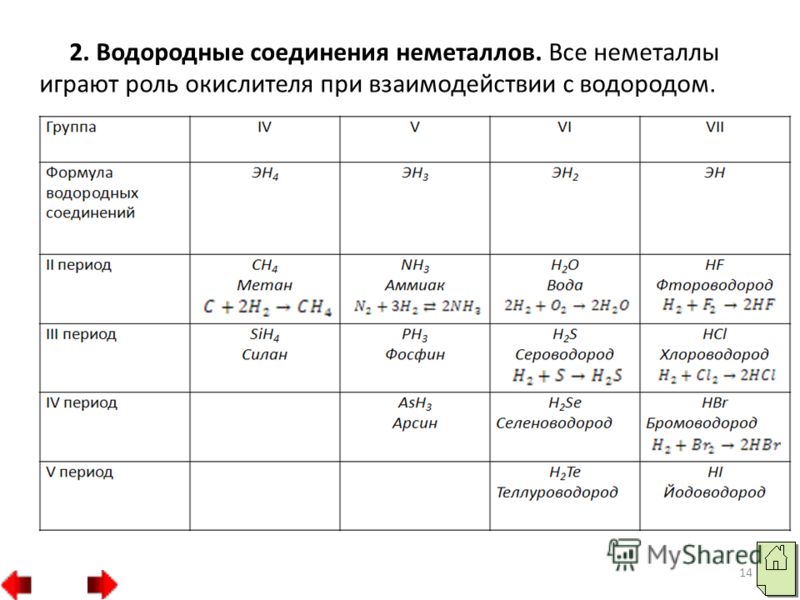
15 Compușii cu hidrogen ai nemetalicilor sunt caracterizați prin relații diferite cu apa. Metanul și silanul sunt slab solubile în apă. Amoniacul și fosfina, atunci când sunt dizolvate în apă, formează baze slabe - hidroxid de amoniu NH 4 OH și hidroxid de fosfoniu pH 4 OH. Când hidrogenul sulfurat, seleniura de hidrogen și telurura de hidrogen, precum și halogenurile de hidrogen, sunt dizolvate în apă, se formează acizi cu aceeași formulă ca și compușii cu hidrogen.

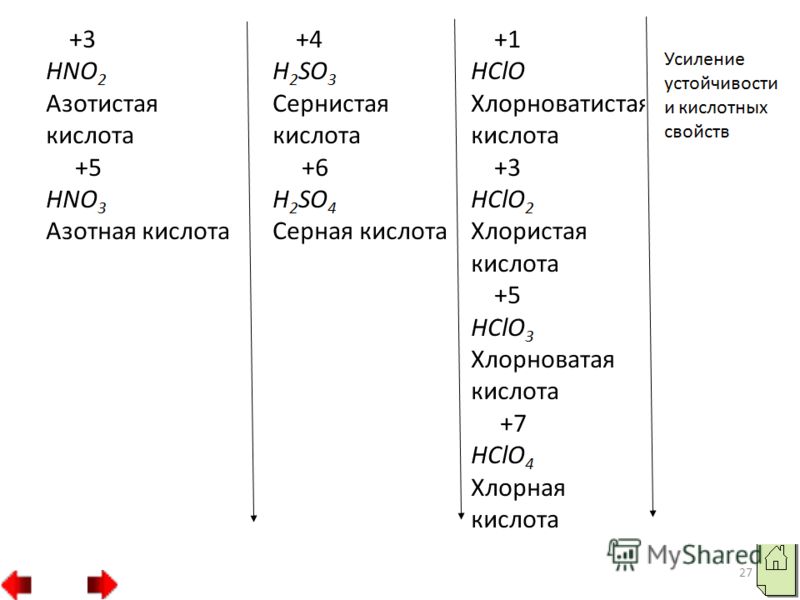
16 În perioade de la stânga la dreapta, proprietățile acide ale compușilor volatili cu hidrogen ai nemetalelor în soluții apoase cresc, iar în grupuri slăbesc. Activitatea oxidativă a compușilor hidrogen ai nemetalelor în grupuri de sus în jos scade foarte mult. HF HCl HBr HI



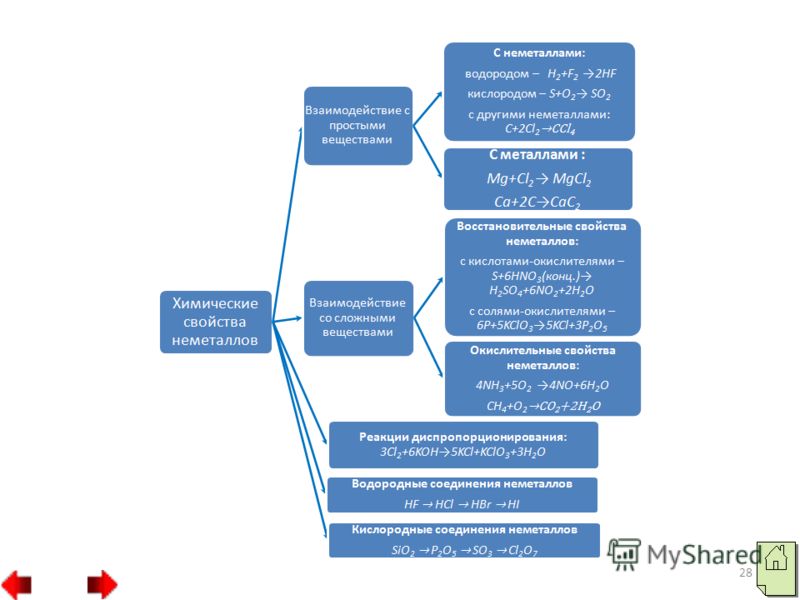
19 5. Nu numai oxigenul, ci și alte nemetale (fluor, iod, brom și altele) pot juca și rolul de agent oxidant în reacțiile cu substanțe complexe. De exemplu, un agent oxidant puternic, clorul, oxidează clorura de fier (II) în clorură de fier (III): Capacitatea unor nemetale de a le înlocui pe altele din soluțiile sărurilor lor se bazează pe diferite activități oxidative:

20 Trebuie subliniat faptul că nemetalele (cu excepția fluorului) pot prezenta și proprietăți reducătoare. În acest caz, electronii atomilor nemetalici se vor amesteca cu atomii elementelor oxidante. În compușii rezultați, atomii nemetalici au stări de oxidare pozitive. Cea mai mare stare de oxidare pozitivă a unui nemetal este de obicei egală cu numărul grupului. Activitatea de reducere a nemetalelor:



23 3. Carbonul și hidrogenul nemetale au cele mai puternice proprietăți reducătoare: Astfel, aproape toate nemetalele pot acționa atât ca agenți oxidanți, cât și ca agenți reducători. Depinde de substanța cu care interacționează nemetalul.

24 Reacțiile de autooxidare-autovindecare (disproporționare) sunt reacții în care același nemetal este atât un agent oxidant, cât și un agent reducător. Acesta este modul în care fosforul, sulful, seleniul și clorul sunt disproporționați în mediile alcaline: nemetalele, care sunt compuși solizi insolubili în apă cu o rețea cristalină puternică (carbon, siliciu) sau slab solubili în apă (oxigen, hidrogen), nu participă la reacții de disproporționare.

25 Oxizii nemetalici sunt împărțiți în două grupe: oxizi care nu formează sare și oxizi care formează sare. Oxizii care nu formează sare includ: N2O, NO, CO. Toți ceilalți oxizi nemetalici formează sare. Oxizii care formează sare ai nemetalelor sunt clasificați ca oxizi acizi. Printre acestea se numără substanțe gazoase (CO 2, SO 2, NO 2), lichide (SO 3, N 2 O 3) și solide (P 2 O 5, SiO 2). Oxizii acizi sunt anhidride acide. De exemplu: CO 2 – anhidridă carbonică H 2 CO 3 ; P 2 O 5 – anhidrida acidului fosforic H 3 PO 4.

26 În principalele subgrupe de sus în jos, proprietățile acide ale oxizilor superiori ai nemetalelor slăbesc, iar în perioade - de la stânga la dreapta cresc: SiO 2 P 2 O 5 SO 3 Cl 2 O 7 Întărirea proprietăților acide Toate oxizii acizi, cu excepția oxidului de siliciu (II) SiO 2, se dizolvă în apă, formând oxizi hidrați, care sunt de natură acidă:

27
28


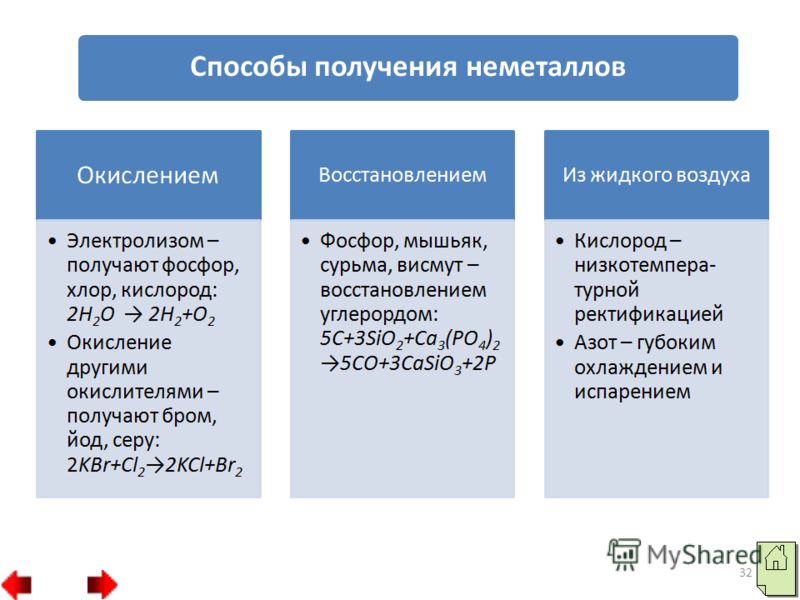
31 2. Unele nemetale pot fi obţinute prin reducere. De exemplu, fosforul, arsenul, antimoniul și bismutul se obțin prin reducerea cu carbon: 3. Metode fizice: a) rectificare la temperatură joasă - așa se obține oxigenul din aer; b) răcire profundă și evaporare - așa se obține azotul din aer

32
33 Întrebări 1. În ce grupe și perioade ale sistemului periodic elemente chimice D.I. Mendeleev a concentrat elemente nemetalice? 2. Care nemetale formează o rețea cristalină atomică, care formează o rețea moleculară și care sunt sub forma atomi individuali? 3. Care nemetale sunt lichide la 20 °C, care nemetale sunt gaze și care sunt solide? 4. Cum se modifică proprietățile nemetalice ale elementelor din tabelul lui D.I Mendeleev în perioade de la stânga la dreapta și în principalele subgrupuri de sus în jos?

34 5. Indicaţi ce elemente se oxidează şi care se reduc în reacţiile substanţelor simple: a) S + O 2 = SO 2; b) S + 2CI2 = SC14; c) CI2 + H2 = 2HCI; d) 2P + 3Br 2 = 2PBr Unele nemetale interacționează cu acizii oxidanți, transformându-se în acizi sau oxizi acizi cu stări de oxidare mai mari. Scrieți ecuațiile pentru următoarele reacții: a) C + H 2 SO 4 (conc.) = b) C + HNO 3 (conc.) = c) S + HNO 3 (conc.) =

Structura și proprietățile substanțelor simple ale nemetalelor.
Cele mai tipice nemetale au o structură moleculară, în timp ce cele mai puțin tipice nemoleculare. Aceasta explică diferența dintre proprietățile lor. Acest lucru se reflectă clar în Schema 2. Substanțe simple Cu structură nemoleculară Cu structură moleculară C, B, SiF2, O2, Cl2, Br2, N2, I2, S8 Aceste nemetale au atom rețele cristaline, prin urmare au duritate mare și puncte de topire foarte mari. Aceste nemetale au rețele de cristal moleculare în stare solidă.
În condiții normale, acestea sunt gaze, lichide sau solide cu puncte de topire scăzute. Tabelul 2 Borul cristalin B, la fel ca siliciul cristalin, are un punct de topire foarte ridicat de 2075C și duritate mare. Conductivitatea electrică a borului crește foarte mult odată cu creșterea temperaturii, ceea ce face posibilă utilizarea pe scară largă în tehnologia semiconductoarelor. Adăugarea de bor în oțel și aliaje de aluminiu, cupru, nichel etc. îmbunătățește proprietățile mecanice ale acestora.
Compușii boruri ai borului cu unele metale, de exemplu titanul TiB, TiB2, sunt necesari la fabricarea pieselor motoarelor cu reacție, palete turbine cu gaz. După cum se poate observa din Schema 2, carbonul C, siliciul Si, borul B au o structură similară și au unele proprietăți generale. Ca substanțe simple, se găsesc sub două forme: cristaline și amorfe. Formele cristaline ale acestor elemente sunt foarte dure, cu puncte de topire ridicate. Siliciul cristalin are proprietăți semiconductoare.
Toate aceste elemente formează compuși cu metalele: carburi, siliciuri și boruri CaC2, Al4C3, Fe3C, Mg2Si, TiB, TiB2. Unele dintre ele au duritate mai mare, de exemplu Fe3C, TiB. Carbura de calciu este folosită pentru a produce acetilenă. Dacă comparăm aranjarea electronilor în orbitali în atomii de fluor, clor și alți halogeni, atunci putem judeca proprietățile lor distincte. Atomul de fluor nu are orbiti liberi. Prin urmare, atomii de fluor pot prezenta doar valența I și starea de oxidare 1. În atomii altor halogeni, de exemplu, în atomul de clor, există orbitali d liberi la același nivel de energie.
Datorită acestui fapt, împerecherea electronilor poate avea loc în trei moduri diferite. În primul caz, clorul poate prezenta starea de oxidare 3 și poate forma acid cloros HClO2, care corespunde sărurilor de clorit, de exemplu cloritul de potasiu KClO2. În al doilea caz, clorul poate forma compuși în care starea de oxidare a clorului este 5. Astfel de compuși includ acidul cloronic HClO3 și sărurile sale clorat, de exemplu clorat de potasiu KClO3 sarea Berthollet. În al treilea caz, clorul prezintă o stare de oxidare de 7, de exemplu în acidul percloric HClO4 și sărurile sale perclorat, de exemplu în perclorat de potasiu KClO4. 4. Compuși cu oxigen și hidrogen ai nemetalelor.
Scurtă descriere a proprietăților lor. Cu oxigen, nemetalele formează oxizi acizi. În unii oxizi, ei prezintă o stare de oxidare maximă egală cu numărul grupului, de exemplu, SO2, N2O5, iar în alții, un grad mai scăzut, de exemplu, SO2, N2O3. Oxizii acizi corespund acizilor, iar dintre cei doi acizi oxigenați ai unui nemetal, cel în care acesta prezintă o stare de oxidare mai mare este mai puternic.
De exemplu, acidul azotic HNO3 este mai puternic decât acidul azotat HNO2, iar acidul sulfuric H2SO4 este mai puternic decât acidul sulfuros H2SO3. Caracteristicile compușilor oxigenați ai nemetalelor 1. Proprietățile oxizilor superiori i.e. oxizi care conţin un element din această grupă cu cel mai înalt grad Perioadele de oxidare se schimbă treptat de la bazic la acid de la stânga la dreapta. 2. În grupuri de sus în jos, proprietățile acide ale oxizilor superiori slăbesc treptat.
Acest lucru poate fi judecat după proprietățile acizilor corespunzători acestor oxizi. 3. Creșterea proprietăților acide ale oxizilor superiori ai elementelor corespondente în perioade de la stânga la dreapta se explică printr-o creștere treptată a sarcinii pozitive a ionilor acestor elemente. 4. În principalele subgrupe ale sistemului periodic de elemente chimice, în direcția de sus în jos, proprietățile acide ale oxizilor superiori ai nemetalelor scad.
Formulele generale ale compușilor cu hidrogen pe grupe ale sistemului periodic de elemente chimice sunt date în Tabelul 3. Formule generale ale compușilor pe grupeIVVVIVIIRHRH2RH3RH4RH3H2RHRNCompuși cu hidrogen nevolatiliCompuși cu hidrogen volatilTabel 3. Cu metale, hidrogenul formează, cu unele excepții, compușii nevolatili, care sunt substanțe solide nu structura moleculara. Prin urmare, punctele lor de topire sunt relativ ridicate.
Cu nemetale, hidrogenul formează compuși volatili cu structură moleculară. În condiții normale, acestea sunt gaze sau lichide volatile. În perioade de la stânga la dreapta, proprietățile acide ale compușilor hidrogen volatili ai nemetalicilor în soluții apoase cresc. Acest lucru se explică prin faptul că ionii de oxigen au perechi de electroni liberi, iar ionii de hidrogen au un orbital liber, apoi are loc un proces care arată astfel: H2O HF H3O F Fluorura de hidrogen în soluție apoasă elimină ionii de hidrogen pozitivi, adică prezintă proprietăți acide.
Acest proces este facilitat și de o altă circumstanță: ionul de oxigen are o pereche de electroni singuri, iar ionul de hidrogen are un orbital liber, datorită căruia se formează o legătură donor-acceptor. Când amoniacul este dizolvat în apă, are loc procesul opus. Și deoarece ionii de azot au o pereche de electroni singuri, iar ionii de hidrogen au un orbital liber, se formează o legătură suplimentară și se formează ionii de amoniu NH4 și ionii de hidroxid OH. Ca rezultat, soluția capătă proprietăți de bază.
Acest proces poate fi exprimat prin formula H2O NH3 NH4 OH Moleculele de amoniac într-o soluție apoasă atașează ioni de hidrogen pozitivi, adică. amoniacul prezintă proprietăți de bază. Acum să vedem de ce compusul hidrogen al fluorului, fluorură de hidrogen HF, într-o soluție apoasă este un acid, dar mai slab decât acidul clorhidric. Acest lucru se explică prin faptul că razele ionilor de fluor sunt mult mai mici decât cele ale ionilor de clor. Prin urmare, ionii de fluor atrag ionii de hidrogen mult mai puternic decât ionii de clor.
În acest sens, gradul de disociere a acidului fluorhidric este semnificativ mai mic decât acid clorhidric, adică acidul fluorhidric este mai slab decât acidul clorhidric. Din exemplele date se pot desprinde următoarele concluzii generale:
Sfârșitul lucrării -
Acest subiect aparține secțiunii:
Nemetale
În diferite epoci istorice, conceptul de element a avut semnificații diferite. Filosofii greci antici considerau patru elemente drept elemente... În Evul Mediu, la aceste principii li s-au adăugat sarea, sulful și mercurul. În secolul al XVII-lea R.... Ulterior s-a dovedit că tabelul cuprindea și câteva substanțe complexe. În prezent, conceptul de substanță chimică...
Dacă aveți nevoie de material suplimentar pe această temă, sau nu ați găsit ceea ce căutați, vă recomandăm să utilizați căutarea în baza noastră de date de lucrări:
Ce vom face cu materialul primit:
Dacă acest material ți-a fost util, îl poți salva pe pagina ta de pe rețelele sociale:





