Proprietățile chimice ale hidroxidului de sodiu. Prepararea hidroxidului de sodiu
Aplicație sodă causticăîn viața de zi cu zi datorită uneia dintre proprietățile sale - de a neutraliza grăsimile și alți contaminanți organici. Capacitatea de a dizolva blocajele din murdărie și acumulări organice ajută la curățarea canalizării în sectorul privat și blocuri de apartamente. În plus, soda caustică (sodă caustică, hidroxid de sodiu, caustică) este, de asemenea, folosită pentru a face săpun cu propriile mâini acasă.
Curățarea conductelor de scurgere și canalizare
Există două moduri de a desfunda o scurgere dintr-o chiuvetă, cadă sau duș, precum și o toaletă sau sistem de canalizareîntr-o casă privată. Primul este mai potrivit pentru curățarea canalizării din sistemul de canalizare al unei case private, al doilea este pentru curățarea sifoanelor și a canalelor de scurgere din clădirile înalte. Instrucțiuni de utilizare, prima opțiune:
- Se toarnă 2 kg de sodă caustică apa rece(4 l);
- soluția rezultată este turnată în canalizare;
- Nu este indicat să scurgeți apa timp de aproximativ o oră: în acest timp, soda caustică descompune grăsimile și alte substanțe organice.
- după o oră se adaugă apă (12-15 litri) la o temperatură de 85-90 ºC.
Cu curățare regulată conducte de canalizare Această metodă garantează că nu va exista miros neplăcut de la țevile din casă, care apare din cauza descompunerii resturilor alimentare și a altor substanțe biologice. Instrucțiuni de utilizare, a doua metodă:
- se toarnă până la 150 g de sodă caustică în gâtul chiuvetei sau al căzii;
- apoi turnați cu grijă până la 2 litri de apă fierbinte pe pulbere;
- dupa 5-10 minute se umple apa calda;
- Nu lăsați apa să pătrundă în gât timp de aproximativ o oră.
Soda caustica poate fi folosita dupa curatarea conductelor cu substante acide pentru a neutraliza efectele agresive.

Curățarea vaselor
Deoarece hidroxidul de sodiu se descurcă bine cu petele de grăsime, este folosit pentru oale și alte ustensile de bucătărie. Este de remarcat imediat că această aplicație nu este potrivită pentru vase de gătit din aluminiu sau teflon. dar emailate, fonta si tigăi de oțel il aduce in stare perfecta. Pentru această procedură aveți nevoie de:
- mare recipient metalic adăugați apă (cel puțin 10 litri);
- adăugați sodă caustică (200 g);
- adăugați 1 tabletă de săpun de rufe ras;
- se toarnă 150 g de lipici de birou (sticlă lichidă);
- amestecați totul bine și puneți vasele în amestecul rezultat;
- se aduce la fierbere si se tine la foc mic inca 2 ore;
- scoateți vasele curățate și spălați-le bine dedesubt apă curgătoare.
În același mod, puteți face față grăsime veche pe farfurii, doar timpul de fierbere se reduce la 10 minute.

Fabricarea săpunului
Caustic este folosit în altă zonă - pentru fabricarea săpunului. Utilizarea sa este obligatorie, deoarece soda caustică este ingredientul principal al săpunului:
- sodă caustică;
- ulei vegetal;
- ulei esențial;
- apă purificată (distilată).
Există multe rețete de săpun în care proporțiile variază și se adaugă ingrediente specifice (acesta este secretul fabricării săpunului), dar folosind ingredientele de bază, poți experimenta și să-ți faci propriul săpun. Pentru a face acest lucru, causticul este combinat cu apă, iar la soluție se adaugă uleiuri vegetale și esențiale. Se amestecă ingredientele până se obține o masă omogenă, apoi se toarnă în forme, unde se întărește în decurs de o zi.
În scopuri cosmetice, aveți nevoie de sodă caustică foarte purificată. Poate fi achiziționat de la magazinele producătorilor de săpun.

Depozitarea sodei caustice și precauții
Pentru a vă da seama cum să depozitați corect soda caustică acasă, trebuie să aflați ce este. Ce este soda caustică? În primul rând, asta substanta chimica– alcali puternic care provoacă arsuri. Prin urmare, atât soluția, cât și pulberea trebuie păstrate la îndemâna copiilor, într-un recipient bine închis, cu o etichetă corespunzătoare. De asemenea, caustica este o substanță inflamabilă și explozivă, prin urmare, trebuie ținută departe de dispozitivele de încălzire și sursele de flacără deschisă.
Soda caustică este depozitată în recipiente etanșe: pulbere în pungi de hârtie sau borcane de plastic și lichid în recipiente dense din polietilenă cu dop de cauciuc. Perioada de valabilitate a lichidului și a granulelor este de 12 luni. O soluție de 3% auto-preparată poate fi păstrată până la 12 luni, dar înainte de utilizare trebuie să verificați dacă s-a format un precipitat. Dacă se observă fulgi în soluție, este posibil ca acesta să fi fost transformat în carbonat de potasiu și să-și piardă proprietățile. Transparența sau opacitatea recipientului nu afectează în niciun fel proprietățile causticului.
Când lucrați cu hidroxid de sodiu, trebuie luate măsuri de precauție:
- lucrul cu mănuși de cauciuc;
- protejați ochii și mucoasele de substanțe chimice;
- nu-i lăsați să intre înăuntru.
Dacă caustică ajunge pe piele, ar trebui să o clătiți imediat cu apă curentă. În caz de ingerare accidentală sau contact cu ochii, este mai bine să consultați imediat un medic, deoarece acest lucru poate provoca probleme grave de vedere (moartea țesutului corneei) sau arsuri ale laringelui și esofagului, precum și ale stomacului.

Încă câteva fapte diferite
Caustic este, de asemenea, folosit în viața de zi cu zi în alte scopuri.
- Pentru dezinfecția fermelor în caz de boli infecțioase periculoase la animale, spațiile sunt tratate cu o soluție de hidroxid de sodiu 4%. Animalele sunt îndepărtate în timpul procesării.
- Când curățați rugina de pe o suprafață metalică cu acid, caustica este ingredientul principal pentru pasivare. După tratarea cu soluții acide, metalul este tratat cu un amestec de formaldehidă, sodă caustică, amoniu și apă.
- Pentru îndepărtarea petelor persistente de grăsime sau păcură de pe îmbrăcăminte. Lucrurile sunt înmuiate timp de 2 ore în apă cu adăugarea unei soluții de hidroxid de sodiu 2% - 1 lingură. lingura pe litru de apa. După aceea sunt șterse în mod obișnuit. Dacă se spală manual, trebuie purtate mănuși de cauciuc.
Atenţie!
Metoda de îndepărtare a petelor cu sodă caustică nu este potrivită pentru țesături de mătase și lână. Într-o soluție caustică de 10% se dizolvă fără urmă, dar o concentrație mai mică va provoca leziuni semnificative acestor țesuturi.
Introducere .
Hidroxidul de sodiu sau hidroxidul de sodiu (NaOH), clorul, acidul clorhidric HC1 și hidrogenul sunt în prezent produse industrial prin electroliza unei soluții de clorură de sodiu.
Soda caustică sau hidroxidul de sodiu - un alcali puternic, numit în mod obișnuit sodă caustică, este utilizată în fabricarea săpunului, în producția de alumină - un produs intermediar pentru producerea de aluminiu metalic, în industria vopselelor și lacurilor, în industria de rafinare a petrolului, în industria producția de raion, în industria sintezei organice și în alte sectoare ale economiei naționale.
Când lucrați cu clor, acid clorhidric, acid clorhidric și sodă caustică, este necesar să respectați cu strictețe regulile de siguranță: inhalarea clorului provoacă o tuse ascuțită și sufocare, inflamarea membranelor mucoase ale tractului respirator, edem pulmonar și formarea ulterioară. a focarelor inflamatorii din plămâni.
Clorura de hidrogen, chiar și la niveluri scăzute în aer, provoacă iritații la nivelul nasului și laringelui, furnicături în piept, răgușeală și sufocare. În cazul intoxicațiilor cronice cu concentrații scăzute sunt afectați în special dinții, al căror smalț este rapid distrus.
Otrăvirea cu acid clorhidric este foarte asemănătoare Cu intoxicație cu clor.
Metode chimice pentru producerea hidroxidului de sodiu.
Metodele chimice pentru producerea hidroxidului de sodiu includ var și ferită.
Metoda varului pentru producerea hidroxidului de sodiu presupune reacția unei soluții de sodă cu lapte de var la o temperatură de aproximativ 80°C. Acest proces se numește causticizare; este descris de reacție
Na2C03 + Ca (OH)2 = 2NaOH + CaC03 (1)
precipitat de soluție
Reacția (1) produce o soluție de hidroxid de sodiu și un precipitat de carbonat de calciu. Carbonatul de calciu este separat din soluție, care este evaporată pentru a produce un produs topit care conține aproximativ 92% NaOH. NaOH topit este turnat în butoaie de fier unde se solidifică.
Metoda feritică este descrisă prin două reacții:
Na 2 C0 3 + Fe 2 0 3 = Na 2 0 Fe 2 0 3 + C0 2 (2)
ferită de sodiu
Na 2 0 Fe 2 0 3 -f H 2 0 = 2 NaOH + Fe 2 O 3 (3)
precipitat de soluție
reacția (2) arată procesul de sinterizare sodă cu oxid de fier la temperatura de 1100-1200°C. În acest caz, se formează ferită de sodiu sinterizată și se eliberează dioxid de carbon. Apoi, turta este tratată (leșiată) cu apă conform reacției (3); se obţin o soluţie de hidroxid de sodiu şi un precipitat de Fe 2 O 3 care, după separarea din soluţie, se reîntoarce în proces. Soluția conține aproximativ 400 g/l NaOH. Se evaporă pentru a obține un produs care conține aproximativ 92% NaOH.
Metodele chimice de producere a hidroxidului de sodiu au dezavantaje semnificative: consumă număr mare combustibil, soda caustică rezultată este contaminată cu impurități, întreținerea dispozitivelor necesită forță de muncă, etc. În prezent, aceste metode sunt aproape complet înlocuite de metoda de producție electrochimică.
Conceptul de electroliză și procese electrochimice.
Procesele electrochimice se numesc procese chimice curgând în soluții apoase sau se topește sub influența constantei curent electric.
Soluțiile și sărurile topite, soluțiile de acizi și alcaline, numite electroliți, aparțin celui de-al doilea tip de conductori în care transferul curentului electric este efectuat de ioni. (La conductoarele de primul fel, de exemplu metale, curentul este transportat de electroni.) Când curentul electric trece printr-un electrolit, ionii sunt descărcați la electrozi și substanțele corespunzătoare sunt eliberate. Acest proces se numește electroliză. Aparatul în care se efectuează electroliza se numește electrolizor sau baie electrolitică.
Electroliza este folosită pentru a produce o serie de produse chimice - clor, hidrogen, oxigen, alcali etc. Trebuie remarcat faptul că electroliza produce produse chimice cu un grad ridicat de puritate, în unele cazuri de neatins cu metode chimice producerea lor.
Dezavantajele proceselor electrochimice includ consumul mare de energie în timpul electrolizei, ceea ce crește costul produselor rezultate. În acest sens, este recomandabil să se efectueze procese electrochimice numai pe baza energiei electrice ieftine.
Materii prime pentru producerea hidroxidului de sodiu.
Pentru a produce hidroxid de sodiu, clor și hidrogen, se folosește o soluție de sare de masă, care este supusă electrolizei Sarea de masă se găsește în natură sub formă de depozite subterane sare gema, în apele lacurilor și mărilor și sub formă de saramură sau soluții naturale. Zăcămintele de sare gemă sunt situate în Donbass, Urali, Siberia, Transcaucazia și alte zone. Unele lacuri din țara noastră sunt și ele bogate în sare.
ÎN ora de vara Apa se evaporă de pe suprafața lacurilor, iar sarea de masă precipită sub formă de cristale. Acest tip de sare se numește sare auto-decantată. ÎN apa de mare conţine până la 35 g/l clorură de sodiu. În locurile cu climă caldă, unde are loc o evaporare intensă a apei, se formează soluții concentrate de clorură de sodiu, din care cristalizează. În măruntaiele pământului, în straturile de sare curg ape subterane, care dizolvă NaCl și formează saramură subterană care ies la suprafață prin foraje.
Soluțiile de sare de masă, indiferent de calea de preparare a acestora, conțin impurități de săruri de calciu și magneziu și, înainte de a fi transferate în atelierul de electroliză, sunt purificate din aceste săruri. Curățarea este necesară deoarece în timpul procesului de electroliză se pot forma hidroxizi de calciu și magneziu slab solubili, care perturbă cursul normal al electrolizei.
Curățarea saramurilor se face cu o soluție de sifon și lapte de var. Pe lângă purificarea chimică, soluțiile sunt eliberate de impuritățile mecanice prin decantare și filtrare.
Electroliza soluțiilor de sare de masă se realizează în băi cu catod solid de fier (oțel) și cu diafragme și în băi cu catod de mercur lichid. În orice caz, electrolizoarele industriale utilizate pentru echiparea magazinelor mari moderne de clor trebuie să aibă performanțe ridicate, un design simplu, să fie compacte, să funcționeze fiabil și constant.
Electroliza soluțiilor de clorură de sodiu în băi cu catod de oțel și anod de grafit .
Face posibilă producerea hidroxid de sodiu, clor și hidrogen într-un singur aparat (electrolizor). Când un curent electric continuu trece printr-o soluție apoasă de clorură de sodiu, ne putem aștepta la eliberarea de clor:
2CI - - 2eÞ C1 2 (a)
precum și oxigen:
20N - - 2eÞ 1/2O 2 + H 2 O(b)
H20-2eÞ1/2Þ2 + 2H+
Potențialul normal al electrodului pentru descărcarea ionilor OH - este + 0,41 V, iar potențialul normal al electrodului pentru descărcarea ionilor de clor este + 1,36 V.Într-o soluție saturată neutră de clorură de sodiu, concentrația ionilor de hidroxil este de aproximativ 1 10 - 7 g-eq/l. La 25°C, potențialul de descărcare de echilibru al ionilor hidroxil va fi
Potențial de descărcare de echilibru, ioni de clor la o concentrație de NaCl în soluție de 4,6 g-eq/l egală
În consecință, oxigenul ar trebui să fie descărcat mai întâi la anod cu supratensiune scăzută.
Cu toate acestea, pe anozii de grafit supratensiunea de oxigen este mult mai mare decât suprapotenţialul de clor şi de aceea se va produce în principal descărcarea ionilor C1 pe aceştia - cu eliberarea de clor gazos conform reacţiei (a).
Eliberarea de clor este facilitată prin creșterea concentrației de NaCI în soluție datorită scăderii valorii potențialului de echilibru. Acesta este unul dintre motivele pentru care se utilizează soluții concentrate de clorură de sodiu care conțin 310-315 g/l.
La catod într-o soluție alcalină, moleculele de apă sunt descărcate conform ecuației
H20 + e = H + OH - (c)
Atomii de hidrogen, după recombinare, sunt eliberați ca hidrogen molecular
2Н Þ Н 2 (g)
Descărcarea ionilor de sodiu din soluții apoase pe un catod solid este imposibilă datorită potențialului lor de descărcare mai mare în comparație cu hidrogenul. Prin urmare, ionii de hidroxid care rămân în soluție formează o soluție alcalină cu ioni de sodiu.
Procesul de descompunere a NaCl poate fi exprimat în acest fel prin următoarele reacții:
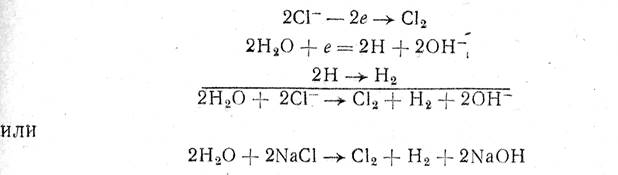
adică se formează clorul la anod, iar la catod se formează hidrogenul și hidroxidul de sodiu.
În timpul electrolizei, împreună cu principalele procese descrise, pot apărea și procese secundare, dintre care unul este descris de ecuația (b). În plus, clorul eliberat la anod este parțial dizolvat în electrolit și hidrolizat în funcție de reacție.
În cazul difuziei alcaline (ioni OH) la anod sau deplasării produselor catodice și anodice, hipocloroși și acid clorhidric neutralizat cu alcali pentru a forma hipoclorit și clorură de sodiu:
HOC1 + NaOH = NaOCl + H20
HC1 + NaOH = NaCI + H20
Ionii de ClO - de la anod sunt ușor oxidați în ClO 3 -. Prin urmare, din cauza proceselor secundare în timpul electrolizei, se va forma hipoclorit de sodiu, clorură și clorat de sodiu, ceea ce va duce la scăderea eficienței curente și a eficienței energetice. Într-un mediu alcalin, eliberarea de oxigen la anod este facilitată, ceea ce va înrăutăți și performanța electrolizei.
Pentru a reduce apariția reacțiilor secundare, trebuie create condiții care să împiedice amestecarea produselor catodice și anodice. Acestea includ separarea spațiilor catodice și anodice printr-o diafragmă și filtrarea electrolitului prin diafragmă în direcția opusă mișcării ionilor OH - către anod. Astfel de diafragme se numesc diafragme filtrante și sunt fabricate din azbest.
Creșterea temperaturii de electroliză și a concentrației de NaCl în electrolit, datorită căreia solubilitatea clorului scade, precum și reducerea concentrației de NaOH în catolit reduc probabilitatea proceselor secundare.
Creșterea temperaturii de electroliză crește nu numai eficiența curentului, ci și conductivitatea electrică a electrolitului, reducând astfel tensiunea pe baie. Astfel, creșterea temperaturii reduce debitul energie electricași, prin urmare, electroliza soluțiilor de clorură de sodiu se efectuează de obicei la 70-80 ° C.
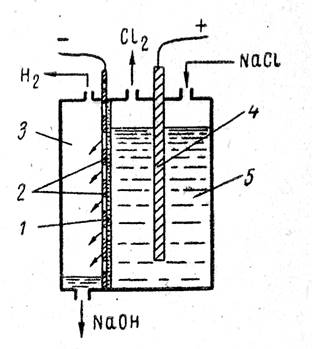
Electrolizatoarele industriale cu diafragmă filtrantă sunt utilizate pe scară largă în industrie. Diagrama unei astfel de băi este prezentată în Fig. 1 Baia are un catod din oțel perforat (cu o gaură) și un anod din grafit. O diafragmă filtrantă din carton de azbest se potrivește strâns pe catod.
 Soluția de clorură de sodiu este introdusă în spațiul anodic, filtrată printr-o diafragmă și ajunge la catod. Viteza de filtrare a electroliților este caracterizată de așa-numita scurgere a diafragmei v
(cm 3 /h)și depinde de aria secțiunii transversale a diafragmei F
(cm 1), presiunea hidrostatică a coloanei de electrolit h
,
grosimea diafragmei b (cm)și vâscozitatea electrolitului μ.
Soluția de clorură de sodiu este introdusă în spațiul anodic, filtrată printr-o diafragmă și ajunge la catod. Viteza de filtrare a electroliților este caracterizată de așa-numita scurgere a diafragmei v
(cm 3 /h)și depinde de aria secțiunii transversale a diafragmei F
(cm 1), presiunea hidrostatică a coloanei de electrolit h
,
grosimea diafragmei b (cm)și vâscozitatea electrolitului μ. Când trece un curent electric continuu, la anod se formează clor, la catod se formează hidrogen și alcali, care, trecând prin orificiile catodului, curge în spațiul catodic și este îndepărtat din baie.
Diagrama unei băi cu diafragmă filtrantă:
1- diafragma; 2 - catod de otel;
3 - spatiu catodic;
4 - anod; 5 - spațiu anod
În băi nu există o descompunere completă a sării de masă și
se stabilește o concentrație constantă de alcali și sare de masă necompusă.
Lichidul electrolitic care curge din baie conține 110-120 g/l NaOH şi 180-170 g/l NaCl.
Electrolizatoarele industriale trebuie să aibă o productivitate mai mare, care se realizează prin creșterea sarcinii. Utilizarea catozilor cu o suprafață foarte dezvoltată face posibilă crearea de electrolizoare compacte cu o sarcină de până la 50.000 O.În acest caz, diafragma este aspirată sau „depusă” pe suprafața catodului dintr-o suspensie de fibre de azbest în soluții salino-alcaline folosind un vid.

Orez. 2. Baie cu diafragma depusă:
1- fund de beton; 2 - catod de otel; 3 - acoperire din beton; 4 - conductă de alimentare cu saramură; 5 - teava pentru eliminarea clorului; 6 - anozi de grafit; 7 - fiting pentru îndepărtarea hidrogenului; 8 - tub pentru scurgerea lichidului electrolitic; 9 - conductor de curent de cupru
nucleu
Un exemplu de baie cu diafragmă depusă este baia Hooker tip S, Fig. 2. Această baie este formată din trei părți principale - un fund de beton, un catod de oțel și un capac de beton. Fundul are forma unui jgheab dreptunghiular, în care capetele inferioare ale anozilor de grafit și o tijă de cupru care servește pentru alimentarea curentului sunt umplute cu plumb. Anozii sunt plăci de grafit. Catodul este un cadru de oțel, în interiorul căruia sunt montate o serie de buzunare plate din plasă de oțel. Amplasarea buzunarelor și lățimea lor sunt astfel încât la instalarea catodului pe fundul băii, buzunarele să fie plasate exact între anozi.
Capacul de baie are orificii pentru alimentarea cu saramură și eliminarea clorului. Electrolizorul are izolație termică care reduce pierderile de energie prin eliberarea de căldură în mediu.
Electroliza soluțiilor de clorură de sodiu în băi cu catod de mercur și anod de grafit.
Face posibilă obținerea de produse mai concentrate decât în băile cu diafragmă.
Când un curent electric continuu trece printr-o soluție de NaCl, are loc o descărcare de ioni C1 pe anodul de grafit, urmată de eliberarea de clor gazos.
2С1 - - 2eÞ C1 2
La catodul de mercur, degajarea hidrogenului are loc cu o supratensiune mare. Dacă la catodul de fier potențialul de degajare a hidrogenului dintr-o soluție neutră este de 0,415 V, apoi pe catodul de mercur este 1,7 - 1,85 V. Sodiul este eliberat pe mercur cu un mare efect de depolarizare, datorită formării amalgamului de sodiu NaHg n, care se dizolvă în exces de mercur. Din această cauză, potențialul de descărcare de sodiu pe catodul de mercur este mai mic decât cel de echilibru și anume 1,2 V, în timp ce potențialul său de echilibru este de 2,71. V. Astfel, la catodul de mercur au loc următoarele procese:
Na++ eÞ Na
Na+ n N g= NaHgn
și aproape nu se eliberează hidrogen.
Amalgamul de sodiu se descompune într-un aparat special - un descompozitor cu apă în funcție de reacție
NaHgn + H20 = NaOH + 1/2H2+ nHg
Electroliza într-o baie cu catod de mercur are loc în medie la o tensiune de 4,3-4,4 V.
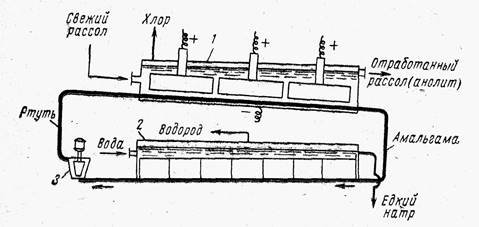
Baie cu catod de mercur, schema circuitului care este prezentat în Fig. 3, este format din două părți: electrolizor și descompozitor.
 Electrolizorul și descompozitorul pot fi separate structural și comunicate între ele printr-o conductă sau pot fi amplasate într-o carcasă comună.
Electrolizorul și descompozitorul pot fi separate structural și comunicate între ele printr-o conductă sau pot fi amplasate într-o carcasă comună. În orice caz, electrolizorul este o cutie dreptunghiulară lungă, închisă deasupra cu un capac în care sunt fixați anozi de grafit. Orez. 3. Diagrama unei băi cu catod de mercur:
1- electrolizor; 2 - descompunetor; 3 - pompa
O magistrală catodică este conectată la fundul ușor înclinat al băii și un strat subțire de mercur se mișcă continuu de-a lungul acesteia. Astfel, fundul băii este catodul. Electrolizorul este alimentat de concentrat (310-315 g/l) soluție de clorură de sodiu, care în timpul electrolizei este epuizată de sare de masă la o concentrație de 260-270 g/l, se scoate din baie, se declorează sub vid și când se sufla cu aer comprimat, se saturează cu sare, se curăță de impurități (neprezentate în diagramă) și se transferă înapoi la electroliză. Clorul rezultat este îndepărtat prin capacul băii.
Când mercurul se deplasează de-a lungul fundului electrolizorului în timpul procesului de electroliză, se obține amalgam de sodiu, care se dizolvă în mercur și este îndepărtat din electrolizor în descompozitor. Descompozitoarele pot fi de diferite modele - orizontale și verticale. Descompozitoarele orizontale sunt un jgheab dreptunghiular acoperit cu un capac. Apa intră în descompozitor și produsele rezultate - hidrogen și alcalii - sunt îndepărtate din acesta. Partea inferioară a descompozitorului are o pantă ușoară, datorită căreia mercurul se mișcă de-a lungul fundului, este îndepărtat din descompozitor și prin ascensoare diverse tipuri transferat la electrolizor.
O baie cu catod de mercur ia suprafețe mari, care este asociat cu locația orizontală a catodului de mercur. Există băi în care discuri verticale amalgamate servesc drept catozi. Aceste băi sunt compacte, dar complexe în design și funcționare.
O comparație a principalilor indicatori de performanță ai băilor de două tipuri arată că, datorită tensiunii ridicate în băile cu catod de mercur, consumul de energie este mai mare decât în băile cu diafragmă. În plus, funcționarea băilor cu catod de mercur este mai complexă decât a celor cu diafragmă, costurile de capital ale instalării acestora sunt mai mari și condițiile de lucru în atelierele dotate cu băi de mercur sunt mai dificile decât în atelierele în care sunt instalate băi cu diafragmă.
Posibilitatea de a obține leșii concentrate fără sare de masă în băile cu mercur este un avantaj semnificativ al băilor cu mercur. Pe baza acestui fapt, în toate cazurile în care este necesar un alcali pur (de exemplu, pentru producția de fibre de viscoză), ar trebui să se acorde preferință băilor cu catod de mercur. Datorită cererii tot mai mari de caustică pură, electroliza în băile cu catod de mercur a devenit larg răspândită.
Alcaliul obținut prin electroliză sub formă de soluții este concentrat în evaporatoare. Alcalii din băile cu diafragmă conține până la 130-140 g/l NaOH şi 180-170 g/l NaCl. Solubilitatea sării de masă scade odată cu creșterea concentrației de NaOH în soluție. Astfel, într-o leșie care conține 50% (769 g/l) NaOH, la 20°C solubilitatea NaCl este 13,9 g/l. Ca urmare, la evaporarea lichidelor electrolitice obținute în băi cu diafragmă, împreună cu concentrarea soluției, are loc cristalizarea clorurii de sodiu, care este revenită la electroliză. Aproape după fierbere și topire, se obține un alcalin care conține 92-94% NaOH și 2-3% NaCl.
Concluzie.
Astfel, hidroxidul de sodiu este produs în prezent prin electroliza unei soluții apoase de clorură de sodiu. În acest caz, se folosesc două tipuri de electrolizoare, fiecare dintre ele având propriile avantaje și dezavantaje. Dar, în ambele cazuri, procesul de producere a hidroxidului de sodiu este însoțit de producerea de subproduse gazoase, care sunt substanțe periculoase atât pentru oameni, cât și pentru mediu. Prin urmare, în această producție trebuie respectate măsuri speciale de siguranță.
Literatură.
1. General tehnologie chimică. Ed. I.P. Muhlenova. Manual pentru specialitățile chimico-tehnologice ale universităților. M.: Liceu.
2. Furmer I.E., Zaitsev V.N. Tehnologia chimică generală. – M.: Liceu, 1978.
(soda caustică) este o substanță solidă albă, sub formă de granule sau de masă topită, cu proprietăți higroscopice. Când este dizolvat, tinde să elibereze căldură. Datorită efectului său distructiv puternic asupra țesuturilor, pielii și a altor substanțe organice, soda caustică (formula NaOH) este numită „alcalin caustic” sau „sodiu caustic” și întreprinderile producătoare- „caustic”. În stare lichidă, este de obicei un lichid colorat sau incolor în care se pot forma sedimente.
Sodă caustică: aplicare
Soda caustică (sodiu caustic) este utilizată pentru nevoile casnice, precum și în diverse industrii. Acesta este cel mai comun alcalin.
Soda caustică și-a găsit aplicație în următoarele domenii:
- soda caustica este un aditiv alimentar inregistrat E524, care este folosit pentru producerea de inghetata, ciocolata, diverse bauturi, ca balsam pentru masline etc.
- în industria celulozei și hârtiei (producția de carton, diferite tipuri hârtie, plăci din fibre de lemn, fibre artificiale și multe altele);
- pentru producerea de combustibil biodiesel, care este fabricat din uleiuri vegetale;
- în industria chimică (pentru producție detergenti, neutralizarea oxizilor și acizilor, pentru titrarea aluminiului, pentru producerea de uleiuri și alte lucruri);
- în industria ușoară (pentru albirea țesăturilor, în producția de mătase);
- în producția de automobile (utilizate la fabricarea bateriilor alcaline);
- în industria alimentară (pentru spălarea echipamentelor; prelucrarea și producția alimentelor).
Producția de sodă caustică
Cea mai comună metodă de producere a hidroxidului de sodiu este electroliza unei soluții apoase de halit (NaCL). Reacția chimică este însoțită de eliberarea de hidrogen și clor.
Soda caustică este adesea produsă prin electroliză folosind catozi de polimer sau azbest (metode cu membrană și diafragmă), mai rar produsă prin electroliză cu un catod de mercur.
Cea mai convenabilă metodă este metoda de producere a mercurului, unde catodul este mercur metalic.
Cu ajutorul coeficientului mare de supratensiune asupra hidrogenului mercur, ionii de sodiu de la catod sunt descărcați, iar rezultatul este un amalgam de sodiu, care se descompune în apa calda. Rezultatul este NaOH foarte pur deoarece nu conține impurități. Cu toate acestea, această metodă este considerată foarte dăunătoare, deoarece utilizarea mercurului metalic provoacă poluarea mediului.
Metodele cu membrană și diafragmă sunt mai eficiente și nu necesită costuri mari. Sunt cele mai des folosite în întreaga lume.

Ambalajul produsului
Soda caustică, în funcție de tipul acesteia, poate fi ambalată în diverse moduri. În stare solidă, este asamblat în tamburi de oțel. Soluția de sodă caustică este turnată în containere speciale pentru automobile și rezervoare de cale ferată.

Depozitarea substanței
Soda lichidă este depozitată în interior, în recipiente închise, care sunt rezistente la alcalii. Hidroxidul de sodiu solid este depozitat ambalat în depozite închise, neîncălzite.
Transport
Soda caustică se transportă prin mijloace de transport (feroviar, rutier și apă). La livrarea hidroxidului de sodiu solid, acest produs este ambalat în saci, iar substanța lichidă este transportată în cisterne și containere feroviare speciale. Când transportați sodă caustică, evitați să o încălziți și să o udați.
Perioada de valabilitate garantată a hidroxidului de sodiu de la data fabricării este de 1 an.

Descriere
Peste 58 de milioane de tone de sodă caustică sunt extrase și utilizate în întreaga lume în fiecare an. Această substanță are greutate specifică 2.13, se poate dizolva bine în apă (la o temperatură de 0 grade - 43%), dar este insolubil în dicloroetan. Hidroxidul de sodiu este folosit pentru a face soluția de degazare nr. 2 în plus, substanța este folosită pentru a degaza zona. Soluția de amoniac-alcalină nr. 2 constă din următoarele componente:
- hidroxid de sodiu (2%);
- amoniac (20%);
- monoetanolamină (5%).
Această soluție este utilizată pentru decontaminarea echipamentelor militare, vehiculelor militare și diferitelor arme care au fost contaminate cu substanțe toxice precum sarin.
Amoniacul și monoetanolamina sunt folosite ca agenți de degazare, precum și pentru a reduce punctul de îngheț al compoziției la -40°C. Această soluție este depozitată în butoaie de fier, al căror volum este de 100 și 250 de litri, și este transportată la unitățile militare și la unitățile de producție din acestea.
O soluție concentrată poate distruge pantofii și țesăturile, precum și corodează pielea oamenilor.
Precauții
Atunci când manipulăm această substanță, nu trebuie să uităm de pericolele pe care le poate conține. Soda caustică (formula NaOH) este caustică, corozivă și aparține clasei de pericol 2. Când lucrați cu acesta, trebuie să luați toate măsurile de precauție necesare. Contactul cu ochii sau pielea poate provoca arsuri chimice grave.
Dacă caustica de sodiu ajunge pe suprafața mucoasă, clătiți imediat zona afectată cu apă curentă, iar în cazul contactului cu pielea, ștergeți cu o soluție de acid acetic.
- ochelari de protecție împotriva stropilor de substanțe chimice (pentru a proteja ochii);
- mănuși de cauciuc (pentru a proteja mâinile);
- costum cauciucat sau îmbrăcăminte de lucru impregnată cu vinil (pentru a proteja trunchiul).
Soda caustică este folosită în multe domenii de producție și chiar în viața de zi cu zi, dar ce este această sodă și de ce este atât de utilă?
Ce este soda caustică?
Soda caustică este una dintre cele mai cunoscute, comune și puternice alcaline. Formula chimică care este NaOH.
Pe lângă cele menționate mai sus, această substanță are și următoarele denumiri: caustic, hidroxid de sodiu, alcalin caustic sau sodă caustică. Hidroxidul însuși este reprezentat de granule solzoase alb, fără miros. Dimensiunea solzilor poate ajunge la 0,5 mm.
Proprietăți utile ale sodei caustice

Substanța are proprietăți higroscopice excelente și se dizolvă destul de bine în lichid. În timpul dizolvării, căldura începe să fie eliberată. Alcalin tolerează cu ușurință absolut orice tip de transport. Depinde starea de agregare. Pentru lichide se folosesc rezervoare pentru solide, pungile vin în ajutor.
Caustic și-a luat o poziție stabilă în multe industrii simultan: medical, chimic, metalurgic, auto, alimentar, ușoară, gaz, petrol.
Substanța este folosită în multe domenii ale industriei, dar, în ciuda acestui fapt, a și făcut-o proprietăți negative. Dezavantajele includ:
- Alcaliul este caustic, este necesar să se folosească echipament de protecție;
- Trebuie să fii atent și să-ți monitorizezi munca, deoarece causticul poate coroda smalțul căzii.
Dar totuși, sifonul are multe aspecte pozitive: 
- Eroziunea sută la sută a depozitelor grase și organice;
- Chiar și după ce canalizările sunt spălate cu el, alcaliul va acționa;
- Netezește cu ușurință orice rugozitate de pe țevi, ceea ce va încetini depunerile;
- Este suficient să utilizați doar o dată pe lună;
- Pret redus si disponibilitate.
- Substanța are proprietăți distructive puternice și poate coroda zincul și aluminiul. Soda este utilizată în procesul de dezinfecție industrială. Soda caustică este explozivă, inflamabilitatea sa este considerată un pericol crescut.
Alte proprietăți ale sodei caustice
- Absolut insolubil în acetonă și eteri;
- Solubilitate ridicată în soluții alcoolice de glicerină, etanol și metanol;
- Substanța este neinflamabilă, punctul de topire - trei sute optsprezece grade Celsius;
- Fierbe la o temperatură de o mie trei sute nouăzeci de grade Celsius;
- Cea mai periculoasă proprietate a causticului este reacția sa ascuțită și violentă la contactul cu metalele aluminiu, plumb, zinc și staniu;
- Este o bază puternică, motiv pentru care este capabilă să formeze un gaz exploziv, inflamabil;
- Un pericol de incendiu apare atunci când soda caustică intră în contact cu amoniacul;
- În stare topită, poate distruge sticla și porțelanul.
Utilizați în viața de zi cu zi acasă

Măsuri de siguranță
Hidroxidul de sodiu este o soluție alcalină puternică care poate coroda cu ușurință aproape orice acoperire. Când utilizați sifon, ar trebui să respectați regulile care vă pot ajuta să vă mențineți sănătatea. Dacă manevrați cu nepăsare alcalii, acesta poate ajunge pe piele și o poate coroda, provocând eczeme sau ulcere. Soda care intră în ochi sau în mucoasele gurii este, de asemenea, plină de mare pericol. Substanța absoarbe perfect lichidul și începe să elibereze căldură, iar în acest caz, o arsură nu mai poate fi evitată. Pentru a preveni acest lucru, trebuie să încercați să respectați regulile atunci când manipulați substanțele caustice.
Instructiuni de utilizare

 Orice drog periculos necesită neapărat o manipulare atentă și atentă, și soda caustică se încadrează în categoria lor. Când cumpărați un amestec de sodă caustică, este serios și important și necesar să studiați absolut totul recomandarile necesare instructiuni de utilizare si trebuie urmate. Apoi, chiar și o substanță nesigură precum caustica va ajuta la treburile casnice și nu va dăuna vieții și sănătății.
Orice drog periculos necesită neapărat o manipulare atentă și atentă, și soda caustică se încadrează în categoria lor. Când cumpărați un amestec de sodă caustică, este serios și important și necesar să studiați absolut totul recomandarile necesare instructiuni de utilizare si trebuie urmate. Apoi, chiar și o substanță nesigură precum caustica va ajuta la treburile casnice și nu va dăuna vieții și sănătății.
Proporții
Când fierbeți fonta și oțelul pentru a îndepărta depunerile de gudron, pentru a elimina vopsea veche de la mașini, pentru a fierbe rame, este necesar un amestec caustic cu o concentrație de cincizeci până la o sută de grame pe litru sau mai mult. Pentru a degresa aluminiul, sunt necesare soluții de hidroxid de sodiu calcinat douăzeci și cinci până la treizeci de grame pe litru, fosfat trisodic douăzeci și cinci până la treizeci de grame pe litru și sticlă lichidă zece până la cincisprezece grame pe litru.
În același timp, temperatura rămâne mereu la 80 de grade Celsius.
Utilizare pe scară largă în viața de zi cu zi

În ciuda tuturor nesiguranței, alcalii caustici sunt folosite peste tot de oameni în viața de zi cu zi. Este folosit ca solvent pentru curățarea țevilor și a vaselor, pentru fabricarea săpunului și în grădinărit.
Perioada de valabilitate a hidroxidului de sodiu este de un an de la data lansării de către producător. După data de expirare, soluția își pierde parțial proprietățile, ceea ce înseamnă că utilizarea sa ulterioară nu va mai putea aduce rezultatul dorit. Se recomandă depozitarea causticului într-un recipient bine închis, într-un loc întunecat și răcoros.
Îndepărtarea calcarului sau a grăsimii
În niciun caz nu trebuie să curățați produsele din aluminiu sau teflon în acest fel, deoarece vasele vor fi deteriorate de substanță. Pentru a detartraja vasele, trebuie să amestecați sifon cu orice pulbere, să diluați cu apă, dar fără a o face prea lichidă și să aplicați pe zona pătată timp de treizeci de minute. Apoi clătiți bine și cântarul se va desprinde.
Aplicație pentru curățarea scurgerii

Soda caustică este, de asemenea, bine folosită nu numai în viața de acasă, ci și în întreprinderi. Pentru a satisface unele nevoi de care avem nevoie diverse solutii. Cea mai frecventă întrebare este: cum trebuie diluată soda caustică pentru a obține un rezultat de înaltă calitate atunci când este utilizată?
Caustic este folosit pentru curățarea canalizării, deoarece soluția poate coroda eficient și ușor depozitele de grăsimi și proteine de pe țevi. Pentru a curăța suprafața țevilor folosind alcali caustici, puteți cumpăra pur și simplu o soluție chimică care conține sodă în sine și apoi turnați-o în orificiul de scurgere.
Câteva alte opțiuni pe care le puteți folosi pentru a vă debloca scurgerile:
- Bicarbonatul de sodiu și oțetul pot fi folosite în alt mod. Este necesar să turnați o sută douăzeci și cinci de grame de oțet în țeavă și să adăugați sodă caustică. După ceva timp, va începe o reacție violentă și de ceva timp va fi eliberată o cantitate destul de mare de spumă. Din acest motiv, se recomandă să sigilați etanș scurgerea cu un dop timp de câteva ore. Când timpul a trecut, turnați apă clocotită în orificiul de scurgere. Această metodă este mai mult decât eficientă pentru îndepărtarea depunerilor de pe suprafața țevilor.
- Mai există și altul, nu mai puțin mod eficient curățarea țevilor Trebuie să amestecați șapte litri de apă cu patru kilograme de sodă caustică. Apoi amestecați totul bine și turnați amestecul rezultat în orificiul de scurgere.
- Puteți scăpa de blocajele din țevi astfel: turnați trei linguri de substanță în scurgere, turnați deasupra două sute cincizeci de grame de apă clocotită. Apoi, ca și în prima metodă, ar trebui să așteptați două până la trei ore. După ce reacția este completă, trebuie să clătiți bine scurgerea cu apă.
Săpun de gătit
Săpunul de mână vândut în magazine costă o grămadă de bani.
Puteți face singur produse cu săpun, pentru aceasta veți avea nevoie de: 
- hidroxid de sodiu;
- ulei;
- apa este curată;
- uleiuri pentru a obține aromă.
Procesul de fabricare a săpunului în sine este foarte simplu, dar necesită o mare precizie și grijă în respectarea tuturor rapoartelor. Sifonul trebuie diluat bine și amestecat în apă. Apoi încălziți uleiul într-o baie de apă și turnați-l în soluția alcalină. După aceasta, ar trebui să obțineți un amestec vâscos și lipicios. Adăugați două sau trei picături ulei esențial, ceea ce face să apară aroma. Puneți rezultatul rezultat în forme pregătite și după douăzeci și patru de ore veți putea folosi săpunul pe care l-ați făcut singur.
Detergenți
În zilele noastre, absolut toate pulberile moderne de spălat conțin întotdeauna sodă caustică. Aceasta înseamnă că puteți utiliza caustic separat în timpul spălării. ÎN maşină de spălat trebuie să adăugați de la trei până la cinci linguri de sifon, cantitatea depinde de cât de murdare sunt hainele. Spălarea trebuie făcută la o temperatură de cincizeci până la o sută de grade Celsius. În plus, bicarbonatul de sodiu poate fi folosit și pentru spălarea mâinilor. Acest lucru va economisi pudra și va îndepărta cu ușurință orice murdărie. La zece litri de apă se adaugă trei linguri de sodă caustică. În timpul procesului de înmuiere, este indicat să înmuiați rufele timp de două ore într-o soluție alcalină. 
Soda caustică poate ajuta, de asemenea, să curețe bine podelele. Mai întâi ar trebui să faci o soluție: trei linguri la cinci litri apă caldă. Cu această metodă, podelele sunt spălate cu soluția alcalină în sine. Apoi, după soluția caustică, podeaua se spală apă platăși ștergeți bine. Dacă utilizați o astfel de substanță, puteți scăpa cu ușurință nu numai de murdărie, ci și dezinfectați eficient și eficient podelele interioare.
În consecință, caustica este adesea folosită în viața de zi cu zi acasă. Substanța este foarte periculoasă, dar utilizarea sa rezonabilă va face o mulțime de lucruri utile și va veni în ajutor în rezolvarea unui număr considerabil de dificultăți și probleme de zi cu zi.
Curățarea canalizării din țevile de plastic
Puteți face pur și simplu un produs de curățare acasă tevi din plastic, folosind lucruri la îndemână, bicarbonat de sodiu și detergent de rufe. Soda va funcționa mai bine și va ajuta dacă amestecați o soluție de sodă caustică și oțet.
- În primul rând, ar trebui să turnați trei sau patru linguri de sodă caustică în gaură, să turnați oțet deasupra și să închideți ermetic scurgerea cu un dop.
- Scoateți pulverizatorul de la duș și introduceți furtunul de duș în orificiu.
- Acoperiți spațiul liber rămas cu un prosop sau o cârpă, deschideți dușul la presiune maximă și clătiți energic scurgerea.
Dacă acest lucru nu aduce rezultatele dorite, atunci există o altă modalitate de a elimina manual blocajul:

Pentru curățarea fosei
Curățarea unei gropi cu sodă caustică este foarte eficientă și eficientă. Dar pentru a obține rezultatul, trebuie să urmați toate regulile necesare de utilizare.
De exemplu, înțelegeți că substanțele chimice violente nu pot lupta doar mirosuri neplăcute deșeurile existente, dar afectează negativ și solul.
Înțelegând acest lucru, nu ar trebui să folosiți prea mult caustic.
Unii oameni care au încercat hidroxidul de sodiu în această chestiune au raportat că acest alcalin poate afecta negativ nu numai pământul, ci și oamenii și animalele.
Una dintre cele mai importante și reguli importante siguranța atunci când curățați o chiuvetă cu caustică este să vă asigurați că groapa este complet etanșă.
În caz contrar, există amenințarea ca insectele să răspândească infecții și boli în afara fosei septice.
În niciun caz nu trebuie să uităm de acumularea gazelor, deoarece în volume mari devin explozive, adică trebuie să faceți un sistem de ventilație care să funcționeze neîntrerupt.
Înainte de toate procedurile, este necesar să se dilueze o soluție de hidroxid de sodiu în apă.
Puteți trece la secvența de acțiuni.
Pentru a face acest lucru aveți nevoie de: 
- găleată de plastic de zece litri;
- lopată mică sau linguriță;
- mănuși de cauciuc;
- masca si ochelari.
Soda caustică nu este turnată în groapă în stare de pulbere, ci este turnată deja dizolvată în apă.
Mai întâi, folosind o linguriță sau o spatulă, turnați de la două până la patru kilograme de apă într-o găleată, cantitatea depinde de volumul gropii în sine.
Apoi, șapte până la opt litri de apă sunt turnați în pulbere și amestecați bine. Când se dizolvă, începe să se elibereze căldură, care puțin mai târziu va ajunge la șaizeci de grade Celsius.
De-a lungul timpului, după ce sifonul s-a dizolvat, masa rezultată este turnată în groapa de gunoi, asigurându-vă că purtați toate echipamentele de protecție posibile: ochelari și mănuși.
Acțiunea activă a amestecului este de patru minute în funcție de numărul de cicluri, ar trebui să fie două.
Nu uita niciodată de dispozitivele de protecție. Dacă alcalii intră pe piele, vor apărea arsuri chimice la contactul mai lung al pielii cu soluția, pot apărea ulcere sau eczeme. Dacă produsul ajunge pe piele, ar trebui să clătiți imediat locul rănii cu un jet copios de apă și apoi cu o soluție de acid boric de două procente.
Dacă ochii sunt afectați, clătiți-i imediat apă caldăîn cinci minute.
Dacă există semne de iritare a pielii, trebuie să consultați un medic.
Aplicarea sodei caustice în industria alimentară

În industria alimentară, caustica este cunoscută ca supliment alimentar – regulator E-524. Folosit pe scară largă în producția de caramel și înghețată, precum și în alte produse precum limonada sau cacao. Soda caustică participă, de asemenea, la procesul de coacere a produselor de copt și a brioșelor pentru a obține o consistență mai plină, iar dacă tratați produsele cu o soluție de alcali caustici înainte de coacere, pâinea va dobândi o crustă crocantă, maro-aurie. Soda este folosită în mod corespunzător și cu înțelepciune pentru a obține cea mai fragedă și moale consistență a diferitelor produse alimentare. De exemplu, peștele este înmuiat în hidroxid de sodiu pentru a obține o masă specială asemănătoare jeleului, care este folosită la prepararea lutefiskului. Există un astfel de fapt: să înmoaie măslinele și să le colorezi culoare închisă Se folosește și soda caustică.
De unde să cumpăr?
În prezent, puteți cumpăra hidroxid de sodiu în aproape orice loc convenabil. Este posibil să cumpărați sodă caustică cu amănuntul în magazinele specializate pentru astfel de produse. În plus, alcalii caustici sunt vândute în vrac, ceea ce este benefic pentru centrele industriale.
La fel ca hidroxidul de sodiu și alte substanțe alcaline, numele „alcali caustici” se datorează proprietății de a coroda pielea, hârtia, sticla și de a provoca arsuri grave. Până în secolul al XVII-lea, alcalii (fr. alcaline) au fost numiți și carbonați de sodiu și potasiu. Omul de știință francez A. L. Duhamel du Monceau a fost primul care a făcut distincția între aceste substanțe: hidroxidul de sodiu a început să fie numit sodă caustică, carbonat de sodiu - sodă (după planta Salsola Soda, din cenușa din care a fost extras) și carbonat de potasiu. - potasiu. În prezent, sărurile de sodiu ale acidului carbonic sunt denumite în mod obișnuit sifon. În engleză și franceză cuvântul sodiu înseamnă sodiu, potasiu - potasiu.
Proprietăți fizice
Hidroxid de sodiu
Termodinamica solutiilor
Δ H0 dizolvarea pentru o soluție apoasă infinit diluată este de -44,45 kJ/mol.
Din soluții apoase la 12,3 - 61,8 °C, cristalizează monohidrat (singonium ortorombic), punctul de topire 65,1 °C; densitate 1,829 g/cm³; ΔH 0 arr.−734,96 kJ/mol), în intervalul de la -28 la -24°C - heptahidrat, de la -24 la -17,7°C - pentahidrat, de la -17,7 la -5,4°C - tetrahidrat ( α-modificare), de la - 5,4 până la 12,3 °C. Solubilitate în metanol 23,6 g/l (t=28 °C), în etanol 14,7 g/l (t=28 °C). NaOH 3,5H20 (punct de topire 15,5°C);
Proprietăți chimice
(în general, o astfel de reacție poate fi reprezentată printr-o ecuație ionică simplă; reacția are loc cu eliberarea de căldură (reacție exotermă): OH-+ H3O+ → 2H2O.)
- cu oxizi amfoteri care au proprietăți atât bazice, cât și acide și capacitatea de a reacționa cu alcalii ca și cu solidele atunci când sunt topite:
ZnO + 2NaOH → Na2ZnO2 + H2O
la fel cu solutiile:
ZnO + 2NaOH (soluție) + H2O → Na2 (soluție)+H2
(Anionul format se numește ion tetrahidroxozincat, iar sarea care poate fi izolată din soluție se numește tetrahidroxozincat de sodiu. Hidroxidul de sodiu suferă, de asemenea, reacții similare cu alți oxizi amfoteri.)
- cu oxizi acizi - cu formarea de săruri; această proprietate este utilizată pentru purificarea emisiilor industriale din gaze acide (de exemplu: CO 2 , SO 2 și H 2 S):
2Na + + 2OH - + Cu 2+ + SO 4 2- → Cu(OH) 2 ↓+ Na 2 SO 4
Hidroxidul de sodiu este folosit pentru precipitarea hidroxizilor metalici. De exemplu, așa se obține hidroxidul de aluminiu asemănător gelului prin reacția hidroxidului de sodiu cu sulfatul de aluminiu în soluție apoasă. Este folosit, în special, pentru purificarea apei din materii mici în suspensie.
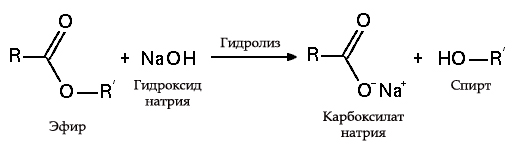
Hidroliza esterilor
- cu grăsimi (saponificare), această reacție este ireversibilă, deoarece acidul rezultat cu alcalii formează săpun și glicerină. Glicerina este ulterior extrasă din lichide de săpun prin evaporare în vid și purificare suplimentară prin distilare a produselor rezultate. Această metodă de a face săpun este cunoscută în Orientul Mijlociu încă din secolul al VII-lea:
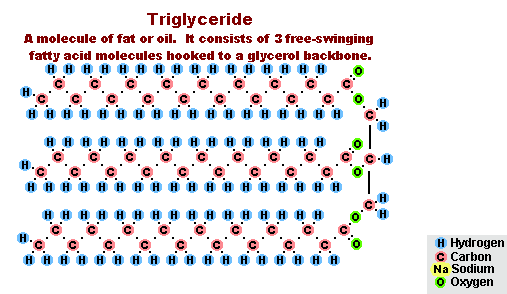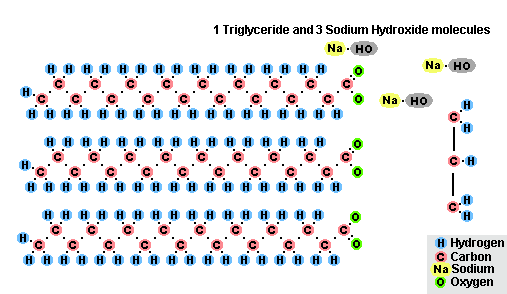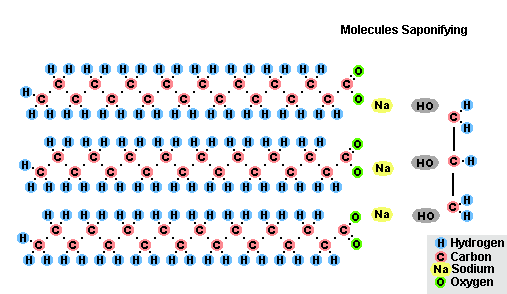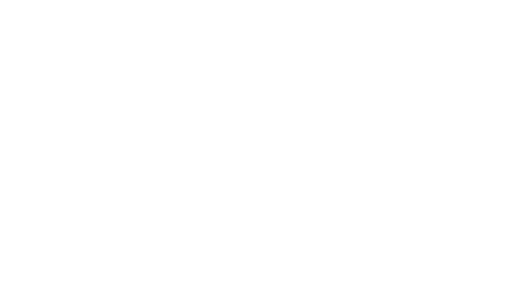
Procesul de saponificare a grăsimilor
Ca urmare a interacțiunii grăsimilor cu hidroxidul de sodiu se obțin săpunuri solide (se folosesc la producerea săpunului), iar cu hidroxidul de potasiu se obțin săpunuri fie solide, fie lichide, în funcție de compoziția grăsimii.
HO-CH2-CH2OH + 2NaOH → NaO-CH2-CH2-ONa + 2H2O
2NaCl + 2H2O = H2 + CI2 + 2NaOH,În prezent, alcalii caustici și clorul sunt produse prin trei metode electrochimice. Două dintre ele sunt electroliza cu un catod solid de azbest sau polimer (metode de producție a diafragmei și membranei), al treilea este electroliza cu un catod lichid (metoda de producție a mercurului). Dintre metodele de producție electrochimică, cea mai ușoară și mai convenabilă metodă este electroliza cu catod de mercur, dar această metodă provoacă daune semnificative. mediu ca urmare a evaporării și scurgerii de mercur metalic. Metoda de producere a membranei este cea mai eficientă, mai puțin consumatoare de energie și cea mai prietenoasă cu mediul, dar și cea mai capricioasă, în special, necesită materii prime de o puritate mai mare.
Alcaliile caustice obținute prin electroliză cu catod de mercur lichid sunt mult mai curate decât cele obținute prin metoda diafragmei. Acest lucru este important pentru unele industrii. Astfel, la producerea fibrelor artificiale se poate folosi numai caustică obținută prin electroliză cu catod de mercur lichid. În practica mondială se folosesc toate cele trei metode de producere a clorului și a sodei caustice, cu o tendință clară spre creșterea ponderii electrolizei membranare. În Rusia, aproximativ 35% din toată soda caustică produsă este produsă prin electroliză cu un catod de mercur și 65% prin electroliză cu un catod solid (metode cu diafragmă și membrane).
Eficiența procesului de producție este calculată nu numai de randamentul de sodă caustică, ci și de randamentul de clor și hidrogen obținut în timpul electrolizei, raportul dintre clor și hidroxid de sodiu la ieșire este 100/110, reacția se desfășoară în urmatoarele rapoarte:
1,8 NaCI + 0,5 H2O + 2,8 MJ = 1,00 CI2 + 1,10 NaOH + 0,03 H2,Indicatori cheie diverse metode producția este dată în tabelul:
| Indicator la 1 tonă de NaOH | Metoda mercurului | Metoda diafragmei | Metoda membranei |
|---|---|---|---|
| randament clor % | 97 | 96 | 98,5 |
| Electricitate (kWh) | 3 150 | 3 260 | 2 520 |
| concentrația de NaOH | 50 | 12 | 35 |
| Puritatea clorului | 99,2 | 98 | 99,3 |
| Puritatea hidrogenului | 99,9 | 99,9 | 99,9 |
| Fracția de masă a O2 în clor, % | 0,1 | 1-2 | 0,3 |
| Fracția de masă a Cl - în NaOH, % | 0,003 | 1-1,2 | 0,005 |
Schema tehnologică a electrolizei cu catod solid
Metoda diafragmei - Cavitatea unui electrolizor cu catod solid este împărțită printr-o partiție poroasă - o diafragmă - în spații catodice și anodice, unde se află catodul și anodul electrolizatorului. Prin urmare, un astfel de electrolizor este adesea numit diafragmă, iar metoda de producție este electroliza cu diafragmă. Un flux de anolit saturat intră continuu în spațiul anodic al electrolizorului cu diafragmă. Ca urmare a procesului electrochimic, clorul este eliberat la anod din cauza descompunerii halitei, iar hidrogenul este eliberat la catod din cauza descompunerii apei. Clorul și hidrogenul sunt îndepărtate din electrolizor separat, fără amestecare:
2Cl - − 2 e= CI20, H2O-2 e− 1/2 O 2 = H 2 .
În acest caz, zona apropiată de catod este îmbogățită cu hidroxid de sodiu. O soluție din zona apropiată de catod, numită lichid electrolitic, care conține anolit necompus și hidroxid de sodiu, este îndepărtată continuu din electrolizor. În etapa următoare, leșia electrolitică este evaporată și conținutul de NaOH din ea este ajustat la 42-50% în conformitate cu standardul. Halitul și sulfatul de sodiu precipită pe măsură ce concentrația de hidroxid de sodiu crește. Soluția alcalină caustică este decantată din sediment și transferată ca produs finit într-un depozit sau în stadiul de evaporare pentru a obține un produs solid, urmat de topire, descuamare sau granulare. Halitul cristalin (sare inversă) este readus la electroliză, preparând așa-numita saramură inversă. Pentru a evita acumularea de sulfat în soluții, sulfatul este îndepărtat din acesta înainte de a prepara saramura inversă. Pierderea de anolit este compensată prin adăugarea de saramură proaspătă obținută prin leșierea subterană a straturilor de sare sau dizolvarea halitului solid. Înainte de a o amesteca cu saramura de retur, saramura proaspătă este curățată de suspensiile mecanice și o parte semnificativă de ioni de calciu și magneziu. Clorul rezultat este separat de vaporii de apă, comprimat și furnizat fie pentru producerea de produse care conțin clor, fie pentru lichefiere.
Metoda membranei - asemănător cu diafragma, dar spațiile anodului și catodic sunt separate printr-o membrană schimbătoare de cationi. Electroliza membranei asigură producerea celei mai pure sodă caustice.
Diagrama tehnologică electrolizăEtapa tehnologică principală este electroliza, aparatul principal este o baie electrolitică, care constă dintr-un electrolizor, un descompozitor și o pompă de mercur, interconectate prin comunicații. În baia electrolitică, mercurul circulă sub acțiunea unei pompe de mercur, trecând printr-un electrolizor și un descompozitor. Catodul electrolizatorului este un flux de mercur. Anozi - grafit sau cu uzură redusă. Împreună cu mercur, un curent de anolit, o soluție de halit, curge continuu prin electrolizor. Ca urmare a descompunerii electrochimice a halitei, la anod se formează ionii Cl - și se eliberează clor:
2 CI - - 2 e= CI20,
care se scoate din electrolizor și se formează pe catodul de mercur soluție slabă sodiu în mercur, așa-numitul amalgam:
Na + + e = Na 0 nNa + + nHg - = Na + HgAmalgamul curge continuu de la electrolizor la descompozitor. Apa, bine purificată de impurități, este, de asemenea, furnizată continuu către descompozitor. În ea, amalgamul de sodiu, ca urmare a unui proces electrochimic spontan, este aproape complet descompus de apă cu formarea de mercur, soluție caustică și hidrogen:
Na + Hg + H20 = NaOH + 1/2H2 + HgSoluția caustică astfel obținută, care este un produs comercial, nu conține amestecul de halit, care este dăunător în producerea viscozei. Mercurul este aproape complet eliberat din amalgamul de sodiu și returnat la electrolizor. Hidrogenul este îndepărtat pentru purificare. Anolitul care părăsește electrolizorul este saturat suplimentar cu halit proaspăt, impuritățile introduse cu acesta, precum și cele spălate din anozi și materialele structurale, sunt îndepărtate din acesta și readuse la electroliză. Înainte de saturare, clorul dizolvat în el este îndepărtat din anolit într-un proces în două sau trei etape.
Metode de laborator de obţinere
Hidroxidul de sodiu este produs în laborator prin mijloace chimice, care sunt mai mult istorice decât practice.
Metoda varului Producerea hidroxidului de sodiu presupune interacțiunea unei soluții de sifon cu lapte de var la o temperatură de aproximativ 80 °C. Acest proces se numește causticizare; este descris de reacția:
Na2C03 + Ca (OH)2 = 2NaOH + CaCO3Ca rezultat al reacției, se formează o soluție de hidroxid de sodiu și un precipitat de carbonat de calciu. Carbonatul de calciu este separat din soluție, care este evaporată pentru a produce un produs topit care conține aproximativ 92% NaOH. NaOH topit este turnat în butoaie de fier unde se întărește.
Metoda feritică descrise prin două reacții:
Na 2 C0 3 + Fe 2 0 3 = Na 2 0 Fe 2 0 3 + C0 2 (1) Na 2 0 Fe 2 0 3 -f H 2 0 = 2 NaOH + Fe 2 O 3 (2)(1) - procesul de sinterizare a sodiului cu oxid de fier la o temperatură de 1100-1200°C. În acest caz, se formează ferită de sodiu și se eliberează dioxid de carbon. Apoi, tortul este tratat (leșiat) cu apă conform reacției (2); se obţin o soluţie de hidroxid de sodiu şi un precipitat de Fe 2 O 3 care, după separarea din soluţie, se reîntoarce în proces. Soluția conține aproximativ 400 g/l NaOH. Se evaporă pentru a obține un produs care conține aproximativ 92% NaOH.
Metodele chimice pentru producerea hidroxidului de sodiu au dezavantaje semnificative: se consumă o cantitate mare de combustibil, soda caustică rezultată este contaminată cu impurități, iar întreținerea dispozitivelor necesită forță de muncă. În prezent, aceste metode sunt aproape complet înlocuite de metoda de producție electrochimică.
Piața de sodă caustică
Producția mondială sodă caustică, 2005| Producător | Volumul producției, milioane de tone | Ponderea în producția mondială |
|---|---|---|
| DOW | 6.363 | 11.1 |
| Compania Occidental Chemical | 2.552 | 4.4 |
| Formosa Plastics | 2.016 | 3.5 |
| PPG | 1.684 | 2.9 |
| Bayer | 1.507 | 2.6 |
| Akzo Nobel | 1.157 | 2.0 |
| Tosoh | 1.110 | 1.9 |
| Arkema | 1.049 | 1.8 |
| Olin | 0.970 | 1.7 |
| Rusia | 1.290 | 2.24 |
| China | 9.138 | 15.88 |
| Alte | 27.559 | 47,87 |
| Total: | 57,541 | 100 |
TR - mercur solid (fulg);
TD - diafragmă solidă (topită);
PP - soluție de mercur;
РХ - soluție chimică;
RD - soluție de diafragmă.
| Numele indicatorului | TR OKP 21 3211 0400 | TD OKP 21 3212 0200 | RR OKP 21 3211 0100 | RH clasa I OKP 21 3221 0530 | RH clasa a II-a OKP 21 3221 0540 | RD Premium grad OKP 21 3212 0320 | RD clasa I OKP 21 3212 0330 |
|---|---|---|---|---|---|---|---|
| Aspect | Masa de fulgi este albă. Culoare deschisă permisă | Masă albă topită. Culoare deschisă permisă | Lichid transparent incolor | Lichid incolor sau colorat. Se admite sedimentul cristalizat | Lichid incolor sau colorat. Se admite sedimentul cristalizat | Lichid incolor sau colorat. Se admite sedimentul cristalizat | |
| Fracția de masă de hidroxid de sodiu, %, nu mai puțin | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
| Numele companiei | 2005 mii de tone | 2006 mii de tone | cota in 2005% | cota in 2006% |
|---|---|---|---|---|
| SA „Kaustik”, Sterlitamak | 239 | 249 | 20 | 20 |
| SA „Kaustik”, Volgograd | 210 | 216 | 18 | 18 |
| OJSC „Sayanskkhimplast” | 129 | 111 | 11 | 9 |
| SRL „Usolyekhimprom” | 84 | 99 | 7 | 8 |
| OJSC Sibur-Neftekhim | 87 | 92 | 7 | 8 |
| SA „Khimprom”, Ceboksary | 82 | 92 | 7 | 8 |
| VOJSC „Khimprom”, Volgograd | 87 | 90 | 7 | 7 |
| CJSC „Ilimkhimprom” | 70 | 84 | 6 | 7 |
| OJSC „KCCHK” | 81 | 79 | 7 | 6 |
| NAC "AZOT" | 73 | 61 | 6 | 5 |
| SA „Khimprom”, Kemerovo | 42 | 44 | 4 | 4 |
| Total: | 1184 | 1217 | 100 | 100 |
| Numele companiei | 2005 tone | 2006 tone | cota in 2005% | cota in 2006% |
|---|---|---|---|---|
| SA „Kaustik”, Volgograd | 67504 | 63510 | 62 | 60 |
| SA „Kaustik”, Sterlitamak | 34105 | 34761 | 31 | 33 |
| OJSC Sibur-Neftekhim | 1279 | 833 | 1 | 1 |
| VOJSC „Khimprom”, Volgograd | 5768 | 7115 | 5 | 7 |
| Total: | 108565 | 106219 | 100 | 100 |






